题目内容
4.一定温度下,10mL0.4mol/LH2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准状况)如下表:下列叙述不正确的是(溶液体积变化忽略不计)( )| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6~10的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应至6min时,c(H2O2)=0.20mol/L | |
| D. | 反应至6min时,H2O2分解了40% |
分析 A.0~6min时间内,生成氧气为$\frac{0.0224}{22.4L/mol}$=0.001mol,则△c(H2O2)=0.002mol÷0.01L=0.2mol/L,根据v=$\frac{△c}{△t}$计算v(H2O2);
B.随着反应的进行,H2O2的浓度逐渐减小,反应速率减慢,小于0~6min时间内反应速率;
C.由A计算可知6min内过氧化氢浓度变化量,6min时的浓度=起始浓度-浓度变化量;
D.H2O2分解率=(H2O2浓度变化量÷H2O2起始浓度)×100%.
解答 解:A.0~6min时间内,生成氧气为$\frac{0.0224}{22.4L/mol}$=0.001mol,由2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,可知△c(H2O2)=0.001mol×2÷0.01L=0.2mol/L,所以v(H2O2)=0.2mol/L÷6min≈0.033mol/(L•min),故A正确;
B.随着反应的进行,H2O2的浓度逐渐减小,反应速率减慢,4~6 min的平均反应速率小于0~6min时间内反应速率,故B正确;
C.由A计算可知,反应至6 min时c(H2O2)=0.4mol/L-0.2mol/L=0.2mol/L,故C正确;
D.6min内△c(H2O2)=0.2mol/L,则H2O2分解率为:$\frac{0.2mol/L}{0.4mol/L}$×100%=50%,故D错误,
故选:D.
点评 本题考查化学平衡有关计算、化学反应速率计算、化学反应速率影响因素等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
12. (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2
在不同温度时K1、K2的值如表:
①反应 CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数K,则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
②能判断恒温恒容容器CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是B(填序号).
A.容器中压强不变 B.混合气体中c(CO)不变 C.容器中密度不变 D.c(CO)=c(CO2)
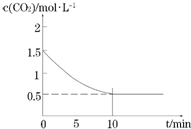
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g),CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为2;0-10min的平均反应速率v(CO)=0.1mol•L-1•min-1;
若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为0.67mol•L-1.
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号)
A.升高温度 B.增大压强 C.充入一定量的CO2D.再加入一定量铁粉.
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2
在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
②能判断恒温恒容容器CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是B(填序号).
A.容器中压强不变 B.混合气体中c(CO)不变 C.容器中密度不变 D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g),CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为2;0-10min的平均反应速率v(CO)=0.1mol•L-1•min-1;
若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为0.67mol•L-1.
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号)
A.升高温度 B.增大压强 C.充入一定量的CO2D.再加入一定量铁粉.
9.下列各原子或离子的基态电子排列式错误的是( )
| A. | N3-:1s22s22p3 | B. | F-:1s22s22p6 | ||
| C. | Fe2+:1s22s22p63s23p63d6 | D. | O2-:1s22s22p6 |
13.半导体工业用石英砂做原料通过三个重要反应生产单质硅:
①SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+682.44kJ•mol-1,
(石英砂) (粗硅)
②Si(s)+2Cl2(g)═SiCl4(g)△H=-657.01kJ•mol-1
③SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s)△H=-625.63kJ•mol-1
(纯硅)
用石英砂生产1.00kg纯硅的总放热为( )
①SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+682.44kJ•mol-1,
(石英砂) (粗硅)
②Si(s)+2Cl2(g)═SiCl4(g)△H=-657.01kJ•mol-1
③SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s)△H=-625.63kJ•mol-1
(纯硅)
用石英砂生产1.00kg纯硅的总放热为( )
| A. | 2.43×104 kJ | B. | 2.35×104 kJ | C. | 2.23×104 kJ | D. | 2.14×104 kJ |
14.在2L的密闭容器中,发生反应3A(g)+B(g)?2Z(g),若最初加入的A和B都是4mol,测得10s内A的平均反应速率υ(A)=0.15mol/(L•s),则反应进行到10s时容器中B的物质的量是( )
| A. | 3 mol | B. | 2.4mol | C. | 2.2mol | D. | 3.2mol/L |
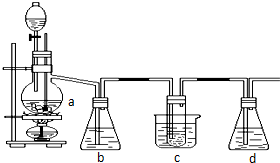 1、2-二溴乙烷可作汽油抗爆剂,常温下它是无色液体,密度2.18g/cm3,沸点131.4 0C,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室可以用下图所示装置制备1、2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管c中装有浓溴水.
1、2-二溴乙烷可作汽油抗爆剂,常温下它是无色液体,密度2.18g/cm3,沸点131.4 0C,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室可以用下图所示装置制备1、2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管c中装有浓溴水. 二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂. 某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程:
某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程: ,试写出:
,试写出: .
. .
. .
. ,
,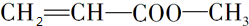 ,
,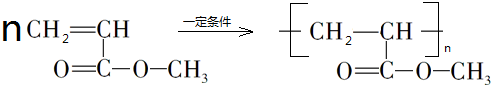 .
.