题目内容
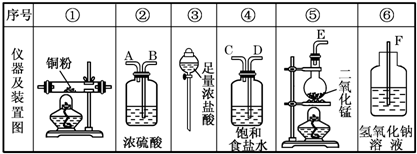
5. 利用硫酸铜晶体制取氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的.回答下列问题:
利用硫酸铜晶体制取氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的.回答下列问题:(1)制取氧化铜的化学反应原理:CuSO4+2NaOH=Cu(OH)2+Na2SO4、Cu(OH)2=CuO+2H2O( 用化学方程式表示)
(2)在过滤黑色固体物质时要用蒸馏水洗涤固体物,为什么要用蒸馏水洗,如何洗涤?
(3)制取氧气的装置如图,如何检查该装置气密性将导管的出口浸入水槽中,手握住试管,有气泡从导管口逸出,放开手后,有少量的水进入导管,表明装置不漏气.
该装置还可以量取生成氧气的体积,以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积.
这三步操作的正确顺序是:②①③(请填写步骤代号).
(4)测量收集到气体体积时,如何使量筒内外液面的高度相同?慢慢将量筒上下移动.
分析 本题利用硫酸铜晶体配制的溶液先与氢氧化钠溶液反应得到不溶性的氢氧化铜,再将通过过滤得到的氢氧化铜受热分解可制得氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的实验探究,涉及制备氧气实验操作,包括气密性的检验,实验步骤及气体的收集;
(1)先制得氢氧化铜,再将氢氧化铜加热使之分解可得氧化铜;
(2)过滤得到的不溶固体,表面有附着溶液,需要洗涤除去,洗涤的方法是在过滤器里添加蒸馏水至浸没不溶物,待水流出后再重复操作几次即可;
(3)装置气密性检验可借助气体热胀冷缩的原理进行,通过排水法收集的气体如何读出体积,需要先恢复到室温,再调整液面,最后读出体积数;
(4)可通过外力的作用,使量筒内外液面的高度相同.
解答 解:(1)制取氧化铜涉及的反应方程式为CuSO4+2NaOH=Cu(OH)2+Na2SO4、Cu(OH)2=CuO+2H2O,故答案为:CuSO4+2NaOH=Cu(OH)2+Na2SO4、Cu(OH)2=CuO+2H2O;
(2)通过洗涤可除去不溶物表面残留的溶液,洗涤方法是向漏斗里注入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次,答:除去沉淀物上吸附的可溶性杂质;向漏斗里注入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次;
(3)制氧气的装置可通过热胀冷缩的原理来检查气密性,具体操作是将导管的出口浸入水槽中,手握住试管,有气泡从导管口逸出,放开手后,有少量的水进入导管,表明装置不漏气,测量排水法收集到的氧气体积时,要待装置冷却并调整液面后再读数,故答案为:将导管的出口浸入水槽中,手握住试管,有气泡从导管口逸出,放开手后,有少量的水进入导管,表明装置不漏气;②①③;
(4)观察量筒内液面,如果比水槽内液面高,可将量筒向下压,反之将量筒上移,使液面相平,故答案为:慢慢将量筒上下移动.
点评 本题考查氧化铜的制备及探究实验室制氧气的操作,重视基础知识的考查,难度较低,提醒学生重视双基的复习,夯实基础是关键.

 “低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.
“低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.I. 用电弧法合成的储氢纳米碳管,可用如下氧化法提纯,请完成下述反应:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6 H2O
II.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,得到如下数据:
| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所 需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | tm |
| III | 900 | 2 | 4 | y | y | tn |
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是D.
A.容器内压强不再变化 B.$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=2
C.混合气体密度不变 D.υ正(CO)=υ逆(CO2)
(3)实验Ⅲ中:y=1.
(4)若实验Ⅲ的容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率a(H2O)随时间变化的示意图,如图所示,b点:υ正>υ逆(填“<”.“=”或“>”).
| A. | 温度升高,Na2CO3溶液pH减小 | |
| B. | 氢氧化钠溶液久置于空气中,溶液pH变大 | |
| C. | 新制氯水经光照一段时间后,溶液pH减小 | |
| D. | 温度升高,纯水pH增大 |
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质C的质量分数增加了 | D. | a+b<c |