题目内容
7.在5L的密闭容器中充入2mol N2和6mol H2,在高温、高压、催化剂下进行反应,达平衡时,测得容器中NH3为1mol.求:(1)达平衡时N2的转化率;
(2)容器中H2的浓度.
分析 在5L的密闭容器中充入2mol N2和6mol H2,达平衡时,测得容器中NH3为1mol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 6 0
变化量(mol):0.5 1.5 1
平衡量(mol):1.5 4.5 1
(1)氮气转化率=$\frac{反应的氮气物质的量}{氮气起始物质的量}$×100%;
(2)根据c=$\frac{n}{V}$计算平衡时氢气浓度.
解答 解:在5L的密闭容器中充入2mol N2和6mol H2,达平衡时,测得容器中NH3为1mol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 6 0
变化量(mol):0.5 1.5 1
平衡量(mol):1.5 4.5 1
(1)N2的转化率=(0.5mol÷2mol)×100%=25%,
答:氮气的转化率为25%;
(2)H2的浓度=4.5mol÷5L=0.9mol/L,
答:氮气的浓度为0.9mol/L.
点评 本题考查化学平衡计算,比较基础,注意三段式解题法在化学平衡计算中的应用,有利于基础知识的巩固.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
17. 对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO-SO3H)磺化得到.实验室可利用右图装置合成对氨基苯磺酸
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO-SO3H)磺化得到.实验室可利用右图装置合成对氨基苯磺酸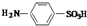
实验步骤如下:
①在一个250mL三口烧瓶中加入10mL苯胺及少量固体B,把烧瓶放入冷水中,缓慢地加入18mL浓硫酸.
②把三口烧瓶置于油浴中缓慢加热,控制温度为180℃~190℃,反应1~1.5h.
③将反应液冷却至约50℃,倒入盛有100mL冷水的烧杯中,析出灰白色固体,进行操作C并用少量冷水洗涤固体,得到对氨基苯磺酸粗产品.
④对粗产品进行操作D,再低温烘干即得到纯净的对氨基苯甲酸.
以下为两种有机物的部分物理性质,请回答有关问题.
(1)由苯胺生成对氨基苯磺酸的反应方程式为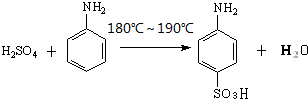 .
.
(2)装置A的名称为冷凝管,作用是使苯胺冷凝回流.
(3)固体 B的作用是防暴沸,操作C的名称是过滤.
(4)下列说法正确的是AD
A.用液体加热的好处是反应物受热均匀,便于控制温度
B.本实验步骤②也可以改用水浴加热
C.步骤③将反应液倒入100mL冷水的目的是分离苯胺和对氨基苯磺酸
D.步骤③用少量冷水洗涤的目的是除去固体表面的可溶性杂质同时减少洗涤过程中的损失.
(5)操作D的名称是重结晶,具体过程包括:用适量热水溶解粗产品→冷却结晶→过滤、洗涤.
 对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO-SO3H)磺化得到.实验室可利用右图装置合成对氨基苯磺酸
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO-SO3H)磺化得到.实验室可利用右图装置合成对氨基苯磺酸
实验步骤如下:
①在一个250mL三口烧瓶中加入10mL苯胺及少量固体B,把烧瓶放入冷水中,缓慢地加入18mL浓硫酸.
②把三口烧瓶置于油浴中缓慢加热,控制温度为180℃~190℃,反应1~1.5h.
③将反应液冷却至约50℃,倒入盛有100mL冷水的烧杯中,析出灰白色固体,进行操作C并用少量冷水洗涤固体,得到对氨基苯磺酸粗产品.
④对粗产品进行操作D,再低温烘干即得到纯净的对氨基苯甲酸.
以下为两种有机物的部分物理性质,请回答有关问题.
| 苯胺 | 对氨基苯磺酸 | |
| 熔点 | -6.3℃ | 288℃ |
| 沸点 | 184℃ | (300℃开始分解炭化) |
| 水溶性 | 微溶于水 | 微溶于冷水、溶于热水 |
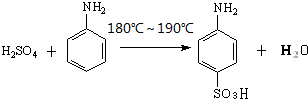 .
.(2)装置A的名称为冷凝管,作用是使苯胺冷凝回流.
(3)固体 B的作用是防暴沸,操作C的名称是过滤.
(4)下列说法正确的是AD
A.用液体加热的好处是反应物受热均匀,便于控制温度
B.本实验步骤②也可以改用水浴加热
C.步骤③将反应液倒入100mL冷水的目的是分离苯胺和对氨基苯磺酸
D.步骤③用少量冷水洗涤的目的是除去固体表面的可溶性杂质同时减少洗涤过程中的损失.
(5)操作D的名称是重结晶,具体过程包括:用适量热水溶解粗产品→冷却结晶→过滤、洗涤.
15.在2L密闭容器中,把4molA和2molB混合,在一定条件下发生反应:3A(g)+2B(g)?4C(g)+2D(g),该反应达到化学平衡状态时,生成1.6molC,则此条件下A的平衡转化率为( )
| A. | 10% | B. | 20% | C. | 30% | D. | 40% |
12.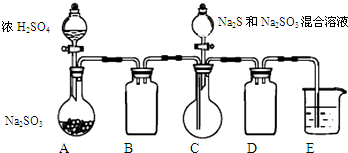 工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.
工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.
已知:i.烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (b)
S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq) (c)
ii.BaS2O3易溶于水.
(1)E中的试剂是NaOH溶液.
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为2:1.
(3)已知反应(c)相对较慢,则烧瓶C中反应达到终点的现象是溶液变澄清(或浑浊消失).
(4)产品中常含有Na2SO3和Na2SO4.该小组设计了以下实验方案进行检验.
①步骤II中加入的试剂可以是B(填序号).
A.稀硫酸 B.稀盐酸 C.稀硝酸 D.氢氧化钠溶液
②步骤II设计过滤操作的目的是(用化学方程式和简要文字表述)分离沉淀,防止溶液中的S2O32-遇酸发生反应:S2O32-+2H+=S↓+SO2↑+H2O,干扰实验观察.
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原实验步骤进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液.
(6)Na2S2O3常用作脱氯剂.Na2S2O3溶液与Cl2反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
 工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.
工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.已知:i.烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (b)
S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq) (c)
ii.BaS2O3易溶于水.
(1)E中的试剂是NaOH溶液.
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为2:1.
(3)已知反应(c)相对较慢,则烧瓶C中反应达到终点的现象是溶液变澄清(或浑浊消失).
(4)产品中常含有Na2SO3和Na2SO4.该小组设计了以下实验方案进行检验.
| 步骤 | 实验操作 | 实验现象 |
| I | 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 |
| II | 过滤,用蒸馏水洗涤沉淀,向沉淀中加入 足量稀盐酸 | 沉淀未完全溶解,并有刺激性气味的气体产生 |
A.稀硫酸 B.稀盐酸 C.稀硝酸 D.氢氧化钠溶液
②步骤II设计过滤操作的目的是(用化学方程式和简要文字表述)分离沉淀,防止溶液中的S2O32-遇酸发生反应:S2O32-+2H+=S↓+SO2↑+H2O,干扰实验观察.
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原实验步骤进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液.
(6)Na2S2O3常用作脱氯剂.Na2S2O3溶液与Cl2反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
16.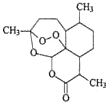 中国科学家屠呦呦因创制了具有国际影响的新型抗疟药--青蒿素和双氢青蒿素,获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
中国科学家屠呦呦因创制了具有国际影响的新型抗疟药--青蒿素和双氢青蒿素,获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
 中国科学家屠呦呦因创制了具有国际影响的新型抗疟药--青蒿素和双氢青蒿素,获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
中国科学家屠呦呦因创制了具有国际影响的新型抗疟药--青蒿素和双氢青蒿素,获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )| A. | 分子中含有3种官能团 | |
| B. | 易溶于苯,难溶于水 | |
| C. | 可与NaOH溶液发生水解反应 | |
| D. | 其同分异构体不可能有芳香族化合物 |
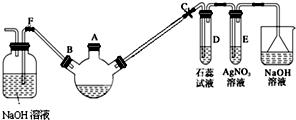 某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯.请分析后回答下列问题:
某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯.请分析后回答下列问题: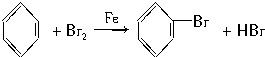 .
.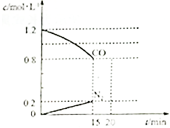 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应: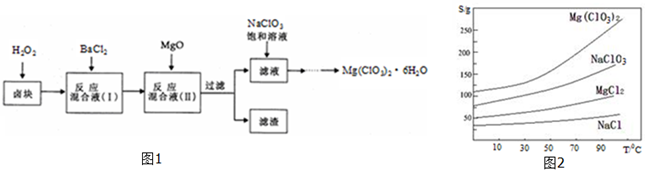
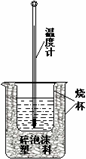 用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: