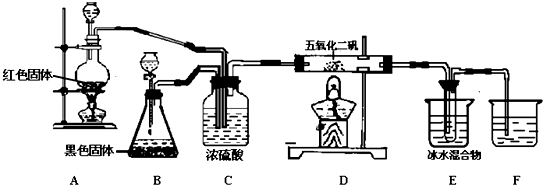
15.实验室里用下列药品和仪器来制取纯净的无水氯化铜:
图中A、B、C、D、E、F的虚线部分表示玻璃管接口,接口的弯曲和伸长等部分未画出.根据要求填写下列各小题空白.
(1)如果所制得气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)
③接⑤接④接②接①接⑥;其中,②与④装置相连时,玻璃管接口(用装置中字母表示)应是接C.
(2)装置⑥中发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(3)实验开始时,应首先检验装置的气密性;实验结束时,应先熄灭①处的酒精灯.
(4)在装置⑤的烧瓶中,发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O
(5)待充分反应后,装置①的玻璃管中呈棕黄色.冷却后,将制得的产物配成溶液,溶液呈绿(或蓝绿)色.
(6)若反应中有71gCl2生成,则被氧化的HCl的物质的量为2mol,转移电子数为2NA.
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  |  |  |  |  |  |
(1)如果所制得气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)
③接⑤接④接②接①接⑥;其中,②与④装置相连时,玻璃管接口(用装置中字母表示)应是接C.
(2)装置⑥中发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(3)实验开始时,应首先检验装置的气密性;实验结束时,应先熄灭①处的酒精灯.
(4)在装置⑤的烧瓶中,发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O
(5)待充分反应后,装置①的玻璃管中呈棕黄色.冷却后,将制得的产物配成溶液,溶液呈绿(或蓝绿)色.
(6)若反应中有71gCl2生成,则被氧化的HCl的物质的量为2mol,转移电子数为2NA.
12.丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的工艺流程如下:
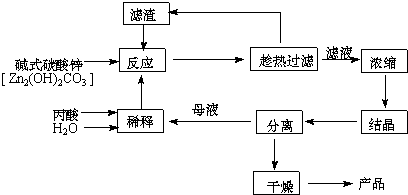
(1)碱式碳酸锌与丙酸反应的化学方程式为:4CH3CH2COOH+Zn2(OH)2CO3→2Zn(CH3CH2COO)2+CO2↑+3H2O.
(2)本题采用趁热过滤的方式,其目的是:防止醋酸锌结晶析出.
(3)实验中用水量不易过少,其原因是水的用量较少时,反应不易完全,且易造成丙酸挥发损失,不利于提高产率和产品的纯度.
(4)探究本实验中最佳工艺条件(见表):反应时间2h,用水量45g,n(丙酸):n(碱式碳酸锌)=1:0.31,反应温度80℃.
(5)某次实验时,将37.0g丙酸溶于220mL水中,按上述流程在上述优化的条件下制备,最终得产品丙酸锌49.6g,则该次实验丙酸锌的产率为:94.0%.
(6)本工艺“采用闭路循环”方式,除具有制备工艺简便、产率高外,还具有:原料利用率高,无废液、废渣排放.
0 172183 172191 172197 172201 172207 172209 172213 172219 172221 172227 172233 172237 172239 172243 172249 172251 172257 172261 172263 172267 172269 172273 172275 172277 172278 172279 172281 172282 172283 172285 172287 172291 172293 172297 172299 172303 172309 172311 172317 172321 172323 172327 172333 172339 172341 172347 172351 172353 172359 172363 172369 172377 203614

| 序号 | n(丙酸):n(碱式碳酸锌) | 反应 温度/℃ | 丙酸锌 产率/% |
| 1 | 1:0.25 | 60 | 67.2 |
| 2 | 1:0.25 | 80 | 83.5 |
| 3 | 1:0.25 | 100 | 81.4 |
| 4 | 1:0.31 | 60 | 89.2 |
| 5 | 1:0.31 | 80 | 90.1 |
| 6 | 1:0.31 | 100 | 88.8 |
(2)本题采用趁热过滤的方式,其目的是:防止醋酸锌结晶析出.
(3)实验中用水量不易过少,其原因是水的用量较少时,反应不易完全,且易造成丙酸挥发损失,不利于提高产率和产品的纯度.
(4)探究本实验中最佳工艺条件(见表):反应时间2h,用水量45g,n(丙酸):n(碱式碳酸锌)=1:0.31,反应温度80℃.
(5)某次实验时,将37.0g丙酸溶于220mL水中,按上述流程在上述优化的条件下制备,最终得产品丙酸锌49.6g,则该次实验丙酸锌的产率为:94.0%.
(6)本工艺“采用闭路循环”方式,除具有制备工艺简便、产率高外,还具有:原料利用率高,无废液、废渣排放.