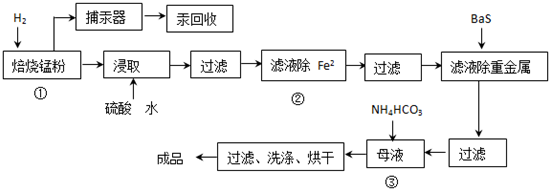
题目内容
9.实验室可用如图装置合成SO3(SO3为无色易挥发的固体,熔点16.8℃,沸点44.8℃);试回答: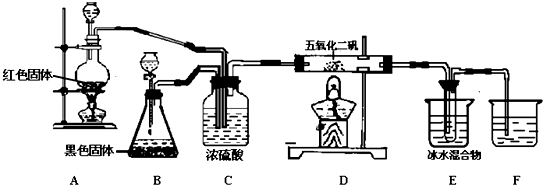
(1)装置B中的黑色固体是:二氧化锰,该物质在反应中所起的作用是催化剂;该反应的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑;
(2)装置C的作用:①干燥气体;②观察气体流速是二氧化硫和氧气以最佳比混合;③使气体混合均匀.
(3)A处反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O D处反应的化学方程式:2SO2+O2$?_{△}^{V_{2}O_{5}}$2SO3
(4)E中冰水混合物的作用是使SO3冷却成固体.
分析 装置A为红色铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,装置B是过氧化氢在黑色固体二氧化锰催化剂作用下分解生成水和氧气,二氧化硫和氧气按照一定比例通过装置C除去气体中的水蒸气,进入装置D在V2O5作用下发生氧化还原反应生成三氧化硫,三氧化硫在装置E中冰水冷却使三氧化硫变化为固体,剩余气体通入装置F吸收,避免污染空气,
(1)装置B中黑色固体为二氧化锰是催化剂,在二氧化锰作用下使过氧化氢分解生成水和氧气;
(2)装置C中的浓硫酸吸收气体中的水蒸气,起到干燥气体的作用,同时可以观察二氧化硫和氧气的流速控制最佳比例,使气体混合均匀;
(3)A处铜和浓硫酸加热反应生成二氧化硫的反应,D处是二氧化硫的催化氧化反应生成三氧化硫;
(4)三氧化硫在温度低的条件下变化为固体,分离出三氧化硫.
解答 解:(1)装置B中黑色固体为二氧化锰是催化剂,在二氧化锰作用下使过氧化氢分解生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑;
(2)装置C中的浓硫酸吸收气体中的水蒸气,起到干燥气体的作用,同时可以观察二氧化硫和氧气冒出的气泡控制气体流速的最佳比例,使气体混合均匀,
故答案为:干燥气体、观察气体流速是二氧化硫和氧气以最佳比混合、使气体混合均匀;
(3)A处铜和浓硫酸加热反应生成二氧化硫的反应,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,D处是二氧化硫的催化氧化反应生成三氧化硫,反应的化学方程式为:2SO2+O2$?_{△}^{V_{2}O_{5}}$2SO3,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,2SO2+O2$?_{△}^{V_{2}O_{5}}$2SO3;
(4)三氧化硫在温度低的条件下变化为固体,分离出三氧化硫,E中冰水混合物的作用是使SO3冷却成固体,
故答案为:使SO3冷却成固体.
点评 本题考查了物质制备的实验过程分析判断,二氧化硫、三氧化硫的制备方法和实验设计,注意试剂的选择和作用分析,掌握基础是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 标准状况下,1.8g水中所含有氧原子数目为0.1NA | |
| B. | 常温常压下,2.24LCO2气体中含氧原子数目为0.2NA | |
| C. | 0.1mol/LCuCl2溶液中,含有Cl-离子的数目为0.2NA | |
| D. | 常温常压下,23gNa+中含有的电子数为NA |
| A. | 反应①、②、③都是氧化还原反应 | |
| B. | 反应①中H2O2被还原 | |
| C. | 氧化性:KMnO4>O2 | |
| D. | 每生成1mol F2,上述反应共转移2mol电子 |
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 2min末浓度/mol•L-1 | 0.08 | a | b |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X的转化率为20% | |
| B. | t℃时,该反应的平衡常数为40 | |
| C. | 前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol•L-1•min-1 | |
| D. | 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 |
(1)工业上可用CO2和H2反应合成甲醇,已知25℃、101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242kJ•mol-1
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O△H2=-676kJ•mol-1
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
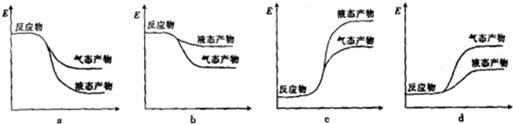
②下列表示合成甲醇反应的能量变化示意图中正确的是a(填字母).
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•l-1,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2?CH3OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性高;
Ⅱ.温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL0.1000mol•L-1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH>(填“<”“>”或“=”)7,原因是HCOO-+H2O?+HCOOH+OH-(用离子方程式表示).
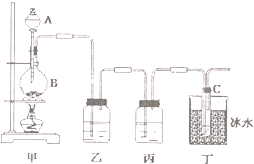 某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题:
某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题: