题目内容
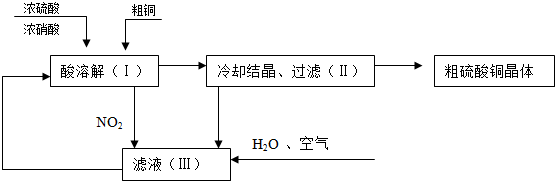
13.实验室以废铁屑为原料制备硫酸亚铁铵晶体[(NH4)2SO4•FeSO4•6H2O],其步骤如下:步骤1:将废铁屑放入碳酸钠溶液中煮沸除油污,倾倒出液体,用水洗净铁屑.
步骤2:向处理过的铁屑中加入过量的3mol•L-1H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液.
步骤3:向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体.
请回答下列问题:
(1)从以下仪器中选择组装,完成实验操作步骤1必需的仪器有①②④⑤⑥⑦(填编号)
①铁架台 ②漏斗 ③广口瓶 ④石棉网 ⑤烧杯 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是加酸抑制亚铁离子的水解;
(3)在步骤3中,所指的“一系列操作”依次是蒸发浓缩、冷却结晶和过滤、洗涤;
(4)为证明所得晶体含有Fe2+和NH4+,取其溶液于试管中加入氢氧化钠溶液,并加热,用湿润的红色石蕊试纸接近试管口,若观察到生成白色沉淀,且迅速变灰绿,最终变为红褐色,同时湿润的红色石蕊试纸变蓝现象,证明含有Fe2+和NH4+.
分析 (1)步骤1是溶液的加热和过滤,结合加热与过滤基本操作选择仪器.
(2)亚铁离子在加热过程中会发生水解.
(3)步骤3是由溶液中获得晶体,是抑制亚铁离子的水解下的蒸发与结晶过程.
(4)Fe2+溶液中加入氢氧化钠溶液,会有白色的氢氧化亚铁沉淀出现,并在空气中会迅速被氧化,NH4+中加入氢氧化钠溶液,并加热,会有能使湿润的红色石蕊试纸变蓝的氨气产生,据此答题;
解答 解:(1)步骤1是溶液的加热和过滤,需要的仪器有:铁架台、漏斗、石棉网、烧杯、玻璃棒、酒精灯,故不需要燃烧匙、广口瓶、研钵.
故选:①②④⑤⑥⑦;
(2)亚铁离子在加热过程中会发生水解,因而要加酸抑制亚铁离子的水解,故所加的硫酸必须过量.
故答案为:加酸抑制亚铁离子的水解;
(3)步骤3是由溶液中获得晶体,亚铁离子在加热过程中会发生水解,应在抑制亚铁离子的水解情况下,蒸发浓缩、冷却结晶、过滤、洗涤等.
故答案为:蒸发浓缩、冷却结晶;
(4)Fe2+溶液中加入氢氧化钠溶液,会有白色的氢氧化亚铁沉淀出现,并在空气中会迅速被氧化,NH4+中加入氢氧化钠溶液,并加热,会有能使湿润的红色石蕊试纸变蓝的氨气产生,所以若观察到生成白色沉淀,且迅速变灰绿,最终变为红褐色,同时湿润的红色石蕊试纸变蓝的现象,即要证明含有Fe2+和NH4+,
故答案为:生成白色沉淀,且迅速变灰绿,最终变为红褐色,同时湿润的红色石蕊试纸变蓝.
点评 考查溶液的加热、过滤、固体溶解、蒸发(防水解)、结晶等一系列实验基本操作、离子检验等,难度不大,是对所学知识的综合运用,注意基础知识的掌握.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
5.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 钠与冷水的反应 | |
| B. | 甲烷在氧气中的燃烧反应 | |
| C. | 灼热的木炭与CO2反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
6.下列说法正确的是( )
| A. | 碱性锌锰电池的负极是锌 | |
| B. | 在船身装锌块不属于牺牲阳极的阴极保护法 | |
| C. | 电解精炼铜时,杂质Fe、Zn、Ag等沉积在电解槽底部 | |
| D. | 钢铁发生吸氧腐蚀时,负极的电极反应式为 2H2O+O2+4e-═4OH- |
18. 碳素利用是环保科学家研究的热点课题.
碳素利用是环保科学家研究的热点课题.
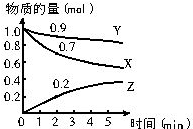
I.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,得到如表数据:
(1)实验I中,前5min的反应速率υ(CO2)=0.1mol/(L.min).
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是BD.
A.容器内压强不再变化 B.n2(H2)=n(H2O)•n(CO)
C.混合气体密度不变 D.υ正(CO)=υ逆(CO2)
(3)实验II和III中CO的平衡转化率:αII(CO)>αIII(CO) (填:>、<或=,下同),T1>T2,a=$\sqrt{3}$-1(填精确数值).
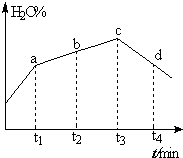
(4)若实验Ⅲ的容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率随时间变化的示意图如图所示,b点υ正>υ逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
(5)CO和H2在一定条件下合成甲醇.甲醇/空气碱性燃料电池中,消耗32g甲醇,电池中有转移4.5mol电子.负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.该电池中电流效率为75%.(电流效率η=$\frac{实际转移电子数}{理论转移电子数}$×100%)
 碳素利用是环保科学家研究的热点课题.
碳素利用是环保科学家研究的热点课题.I.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,得到如表数据:
| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所 需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | T1 |
| III | 900 | 2 | 2 | a | a | T2 |
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是BD.
A.容器内压强不再变化 B.n2(H2)=n(H2O)•n(CO)
C.混合气体密度不变 D.υ正(CO)=υ逆(CO2)
(3)实验II和III中CO的平衡转化率:αII(CO)>αIII(CO) (填:>、<或=,下同),T1>T2,a=$\sqrt{3}$-1(填精确数值).
(4)若实验Ⅲ的容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率随时间变化的示意图如图所示,b点υ正>υ逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
(5)CO和H2在一定条件下合成甲醇.甲醇/空气碱性燃料电池中,消耗32g甲醇,电池中有转移4.5mol电子.负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.该电池中电流效率为75%.(电流效率η=$\frac{实际转移电子数}{理论转移电子数}$×100%)
5.合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途.下图是以天然气为主要原料制备合成气,并用合成气生产甲醇和二甲醚(CH3OCH3)及炼铁的一种工艺流程:
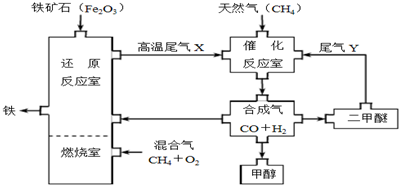
(1)在用合成气炼铁的流程中,向燃烧室通入甲烷与氧气的最佳体积配比V(CH4):V(O2)为1:2.
(2)尾气Y的成分与合成气的配比有关,则合成二甲醚时所发生的反应可能有2CO+4H2=CH3OCH3+H2O、3CO+3H2=CH3OCH3+CO2.
(3)在催化反应室中所发生的反应为可逆反应,则低压(填“高压”或“低压”)有利于合成气的合成.
(4)以Cu2O/ZnO为催化剂,由合成气合成甲醇可在一定温度和压强下自发进行,则反应:CO(g)+2H2(g)?CH3OH(g)在高温、低压条件下一定不能自发进行.为探究合成甲醇的适宜温度和压强,某同学设计了如下三组实验:
则T1=250,P1=5.

(1)在用合成气炼铁的流程中,向燃烧室通入甲烷与氧气的最佳体积配比V(CH4):V(O2)为1:2.
(2)尾气Y的成分与合成气的配比有关,则合成二甲醚时所发生的反应可能有2CO+4H2=CH3OCH3+H2O、3CO+3H2=CH3OCH3+CO2.
(3)在催化反应室中所发生的反应为可逆反应,则低压(填“高压”或“低压”)有利于合成气的合成.
(4)以Cu2O/ZnO为催化剂,由合成气合成甲醇可在一定温度和压强下自发进行,则反应:CO(g)+2H2(g)?CH3OH(g)在高温、低压条件下一定不能自发进行.为探究合成甲醇的适宜温度和压强,某同学设计了如下三组实验:
| 实验编号 | n(H 2)/n(CO) | T/℃ | P/MPa |
| i | m1 | 250 | 1 |
| ii | 3 | T1 | 5 |
| iii | m2 | 350 | P1 |