题目内容
6.硫酸铜是一种应用极其广泛的化工原料.某同学利用车床加工的废铜屑制备硫酸铜.实验前先将废铜屑置于Na2CO3溶液中煮沸5分钟,然后汲去Na2CO3溶液,再用蒸馏水洗涤3次.由于铜不与稀硫酸直接反应,实验中将浓硝酸分次加入到铜粉与稀硫酸中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示,烧杯中盛有NaOH溶液).
(1)实验前先将废铜屑于Na2CO3溶液中煮沸5分钟的目的是除去油污.
(2)圆底烧瓶中发生的离子反应方程式为3Cu+8H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$3Cu2++2NO↑+4H2O.
(3)图2是图1的改进装置,改进后的好处是能防止倒吸.
(4)为符合绿色化学的要求,某研究性学习小组改用空气氧化法:
方案1:将铜屑在空气中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜屑与稀硫酸的混合物中,发现在常温下几乎不反应.但是向反应液中加少量FeSO4或Fe2(SO4)3溶液,反应很快进行.反应完全后,继续通入空气并加物质甲调节pH值到3~4,产生Fe(OH)3沉淀.过滤,滤渣作催化剂循环使用.滤液经过蒸发浓缩、结晶、减压抽滤后得到蓝色晶体,再用少量95%的酒精洗涤晶体后晾干,得CuSO4•5H2O10.6g.己知Fe(OH)3和Cu(OH)2完全沉淀时的pH值分别为3.7、6.4请回答下列问题:
①方案2中甲物质可能是A(填字母).A.CaO B.CuO C.Na2CO3D.NaOH
②FeSO4或Fe2(SO4)3溶液的作用是催化剂,不能选用FeCl3、FeCl2代替
FeSO4、Fe2(SO4)3溶液的原因是防止制得的硫酸铜晶体中混有CuCl2(或制得的硫酸铜晶体不纯).
③晶体采用95%的酒精淋洗的优点是减少硫酸铜晶体在洗涤过程中由于溶解引起的损耗(或减少硫酸铜晶体的损失、减少硫酸铜晶体的溶解).
④图3是抽滤装置的一部分,其中正确的是A.(填A或B)
⑤采用方案1以64g铜为原料与一定质量的57.6%(填质量分数)的硫酸反应在理论上不需要蒸发水刚好生成CuSO4•5H2O晶体.(结果保留3位有效数字)
分析 (1)碳酸钠为强碱弱酸盐,水解溶液呈碱性,能清除油污;
(2)铜不与稀硫酸直接反应,但将浓硝酸分次加入,酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水;
(3)空气和一氧化氮通入氢氧化钠溶液可以被吸收,但图1不能防止氢氧化钠倒吸到烧瓶中,图2是图1的改进装置,能防止倒吸;
(4)①调节溶液的PH时,不能引进杂质离子,且所加的物质可以和酸发生反应即可;
②FeSO4作催化剂,不能选用FeCl3、FeCl2代替,因它们能引进杂质离子,制得的硫酸铜晶体中混有CuCl2;
③晶体采用酒精淋洗能减少晶体的溶解;
④布氏漏斗的颈口斜面应朝向抽滤瓶的支管口;
⑤在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜,依据2Cu+2H2SO4+O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4•5H2O计算.
解答 解:(1)Na2CO3溶液中存在水解离子反应为CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,溶液呈碱性,油污在碱性条件下发生水解,所以实验前先将废铜屑于Na2CO3溶液中煮沸5分钟,目的是除去油污,
故答案为:除去油污;
(2)铜不与稀硫酸直接反应,但将浓硝酸分次加入,酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水,反应方程式为3Cu+2HNO3+3H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$3Cu2++2NO↑+4H2O;
(3)空气和一氧化氮通入氢氧化钠溶液可以被吸收,但图1不能防止氢氧化钠倒吸到烧瓶中,图2中第2个集气瓶,进入瓶内的导管一点点,能防止氢氧化钠倒吸到烧瓶中,
故答案为:能防止倒吸;
(4)①调节溶液的PH时,不能引进杂质离子,且所加的物质可以和酸发生反应即可,所以甲物质为CuCO3或CuO;
故答案为:A;
②向反应液中加少量FeSO4或Fe2(SO4)3溶液,反应很快进行,说明FeSO4或Fe2(SO4)3溶液作催化剂,如向反应液中加少量FeSO4,即发生反应:2Fe3++Cu=2Fe2++Cu2+,4Fe2++O2+4H+═4Fe3++2H2O,FeSO4作催化剂,不能选用FeCl3、FeCl2代替,因它们能引进杂质氯离子,制得的硫酸铜晶体中混有CuCl2,
故答案为:催化剂;防止制得的硫酸铜晶体中混有CuCl2(或制得的硫酸铜晶体不纯);
③硫酸铜是无机物,在酒精中溶解度较小,晶体采用酒精淋洗的优点是酒精易挥发且与水以任意比例溶解,减少晶体的溶解,
故答案为:减少硫酸铜晶体在洗涤过程中由于溶解引起的损耗(或减少硫酸铜晶体的损失、减少硫酸铜晶体的溶解);
④抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,抽滤装置中,布氏漏斗的颈口斜面应朝向抽滤瓶的支管口,以保证得到要抽滤的物质,A符合,
故答案为:A;
⑤64g铜的物质的量为n=$\frac{64g}{64g/mol}$=1mol,采用方案1制得1molCuSO4•5H2O晶体,与一定质量的硫酸反应在理论上不需要蒸发水刚好生成CuSO4•5H2O晶体,反应为:2Cu+2H2SO4+O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4•5H2O,即需1mol硫酸,4mol水,所以硫酸的质量分数为:$\frac{1mol×98g/mol}{1mol×98g/mol+4mol×18g/mol}$×100%≈57.6%,
故答案为:57.6%.
点评 本题考查学生对工艺流程的理解、阅读题目获取信息能力、物质分离提纯等基本操作等,题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力,注意⑤依据2Cu+2H2SO4+O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4•5H2O计算.

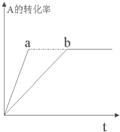 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )| A. | 增大A的浓度 | B. | 扩大容器的容积 | C. | 加入催化剂 | D. | 升高温度 |
| A. | 将Al条投入NaOH溶液中:Al+OH-+H2O═AlO${\;}_{2}^{-}$+H2↑ | |
| B. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| C. | 向CuSO4溶液中加入Na2O2:Na2O2+2Cu2++2H2O═2Na++2Cu(OH)2↓+O2↑ | |
| D. | 将0.2 mol/L的NH4Al(SO4)2溶液与0.3 mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
 碳素利用是环保科学家研究的热点课题.
碳素利用是环保科学家研究的热点课题.I.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,得到如表数据:
| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所 需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | T1 |
| III | 900 | 2 | 2 | a | a | T2 |
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是BD.
A.容器内压强不再变化 B.n2(H2)=n(H2O)•n(CO)
C.混合气体密度不变 D.υ正(CO)=υ逆(CO2)
(3)实验II和III中CO的平衡转化率:αII(CO)>αIII(CO) (填:>、<或=,下同),T1>T2,a=$\sqrt{3}$-1(填精确数值).
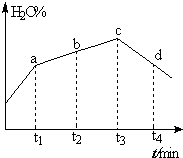
(4)若实验Ⅲ的容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率随时间变化的示意图如图所示,b点υ正>υ逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
(5)CO和H2在一定条件下合成甲醇.甲醇/空气碱性燃料电池中,消耗32g甲醇,电池中有转移4.5mol电子.负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.该电池中电流效率为75%.(电流效率η=$\frac{实际转移电子数}{理论转移电子数}$×100%)
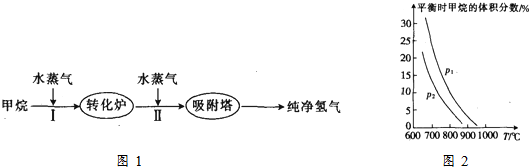
(1)阶段I发生的反应为CH4(g)+H2O(g)?CO(g)+3H2(g).
①写出该反应的平衡常数表达式$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$;
②已知在“水碳比”$\frac{c({H}_{2}O)}{c(C{H}_{4})}$=3时,测得温度(T )和压强(p)对上述反应的影响如图2所示.则升高温度,该反应的平衡常数K增大(填“增大”、“减小”或“不变”),据图可知P1>P2.(填“>”、“<”或“=”)
(2)阶段Ⅱ发生的反应为CO(g)+H2O(g)?CO2(g)+H2 (g),T1温度时,向2L的恒容密闭容器中通入一定量的CO和H2O(g),反应过程中测得部分数据如表所示(表中t1<t2):
| 反应时间(min) | n(CO)(mol) | N(H2O)(mol) |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
②若达到平衡后,保持其他条件不变,只是向原平衡体系中再通入0.20mol H2O(g),则下列说法正确的是ab.
a、CO的转化率将增大 b、H2O(g)的体积分数将增大
c、气体的密度将不变 d、化学平衡常数将增大.


 某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小. ;
; ;
;