题目内容
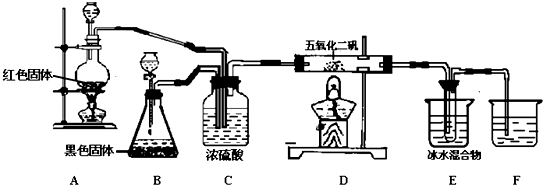
14.三草酸合铁酸钾晶体易溶于水,难溶于乙醇,可用作某些化学反应的催化剂,化学式为K3[Fe(C2O4)3]•3H2O.实验室以铁屑为原料制备三草酸合铁酸钾晶相关反应过程如图所示:请回答下列问题:
(1)制备过程中加入H2O2目的是将Fe2+氧化为Fe3+,得到K3[Fe(C2O4)3]溶液后,需要加入乙醇,其目的是因为三草酸合铁酸钾晶体易溶于水,难溶于乙醇所以加入乙醇,便于析出.
(2)晶体中所含的结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复脱水、冷却、称量至恒重,⑥计算.步骤5的目的是确保结晶水全部失去.
(3)C2O42-可被高锰酸钾溶液氧化放出CO2,测定产物中K3[Fe(C2O4)3]•3H2O含量时,可用酸性高锰酸钾标准溶液进行滴定.
①写出滴定过程中发生反应的离子方程式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
②取10.0g产物配成100ml溶液,从中取出20ml于锥形瓶中,用0.1mol/L的酸性高锰酸钾溶液进行滴定,达到滴定终点时消耗酸性高锰酸钾溶液24ml.则产物中K3[Fe(C2O4)3]•3H2O的质量分数为49.1%.(K3[Fe(C2O4)3]•3H2O相对分子质量为491)

分析 (1)前面生成的是草酸亚铁,加入过氧化氢可以将Fe2+氧化为Fe3+,三草酸合铁酸钾在乙醇中溶解度小,三草酸合铁酸钾晶体易溶于水,难溶于乙醇所以加入乙醇,便于析出;
(2)晶体易吸水,为防止吸水步骤③需要在干燥器中进行,步骤⑤的是检验晶体中的结晶水是否已全部失去;
(3)①化合价C:+3→+4,改变量(4-3)×2=2,Mn:+7→+2,改变量(7-2)×1=5,根据化合价升降总数相等,所以在C2O42-前配5,MnO4-前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配10和2,根据电荷守恒,在H+前配16,最后根据离子方程式两边的H个数相等在水前面配8;
②草酸根离子被高锰酸钾氧化成二氧化碳,本身被还原成锰离子,根据方程式是分析,0.1mol•L-1的酸性高锰酸钾溶液进行滴定,达到滴定终点时消耗酸性高锰酸钾溶液24mL,则草酸根离子物质的量浓度为$\frac{5×0.1×0.024}{2×0.02}$=0.3mol/L,所以10.0克中三草酸合铁酸钾晶体的物质的量为0.3×$\frac{0.1}{3}$=0.01摩尔,其质量分数为0.01×$\frac{491}{10.0}$×100%=49.1%.
解答 解:(1)前面生成的是草酸亚铁,加入过氧化氢可以将Fe2+氧化为Fe3+;根据相似相溶原理知,三草酸合铁酸钾在乙醇中溶解度小,三草酸合铁酸钾晶体易溶于水,难溶于乙醇所以加入乙醇,便于析出,得到K3[Fe(C2O4)3]溶液后,需要加入乙醇,其目是可以用乙醇使三草酸合铁酸钾析出,
故答案为:将Fe2+氧化为Fe3+,因为三草酸合铁酸钾晶体易溶于水,难溶于乙醇所以加入乙醇,便于析出;
(2)晶体易吸水,为防止吸水步骤③需要在干燥器中进行,步骤⑤的是检验晶体中的结晶水是否已全部失去,重复脱水,是为了确保结晶水全部失去,
故答案为:确保结晶水全部失去;
(3)①化合价C:+3→+4,改变量(4-3)×2=2,Mn:+7→+2,改变量(7-2)×1=5,根据化合价升降总数相等,所以在C2O42-前配5,MnO4-前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配10和2,根据电荷守恒,在H+前配16,最后根据离子方程式两边的H个数相等在水前面配8,经检验离子方程式两边的氧原子相等,得到离子方程式为5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O,
故答案为:5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O;
②5K3[Fe(C2O4)3]•3H2O~15C2O42-~6MnO4-
5×491g 6mol
x 24.00mL×10-3×0.1mol•L-l
x=0.982
K3[Fe(C2O4)3]•3H2O的质量分数$\frac{0.982g}{2g}$×100%=49.1%,
故答案为:49.1%.
点评 本题考查了实验方案的设计,离子方程式的书写,中和滴定的计算,掌握基础是解题关键,题目难度中等.

| A. | vA=0.005 mol•(L•min)-1 | B. | vC=0.025mol•(L•min)-1 | ||
| C. | vB=0.150mol•(L•min)-1 | D. | vD=0.015mol•(L•min)-1 |
| A. | 铝片加入到少量浓烧碱溶液中:Al+3OH-═Al(OH)3 | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,使SO42-全部沉淀:2Al++6OH-+3SO42-+3Ba2+═2Al(OH)3↓+3BaSO4↓ | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++2OH-+SO42-+Ba2+═BaSO4↓+2H2O | |
| D. | 用惰性电极电解 饱和氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ |
为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(SO2)(mol•L-1) | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 | 3.00×10-37 |
| c(CO)(mol•L-1) | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 | 2.00 |
(1)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速率v(CO2)=0.77mol/(L•s).
(3)在该温度下,反应的平衡常数K=3.33×1036.
(4)假设在密闭容器中发生上述反应,达到平衡时,下列措施既不会提高成本,又能提高SO2转化率的是BC.
A.选用更有效的催化剂 B.提高n(CO):n(SO2)投料比
C.降低反应体系的温度 D.缩小容器的体积
(5)为了分别验证不同催化剂、温度、浓度对化学反应速率的影响规律,某同学设计了四组实验使反应速率依次增大,部分实验条件已经填在下面实验设计表中.
| 实验 编号 | T(℃) | SO2初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂 |
| Ⅰ | 260 | 1.00 | 3.00 | Cr2O3 |
| Ⅱ | Fe2O3 | |||
| Ⅲ | 380 | |||
| Ⅳ | 4.00 |
②研究表明:Fe2O3的催化效果好于Cr2O3.请在答题卷相应位置画出上表中的四个实验条件下混合气体中SO2浓度随时间变化的趋势曲线图,并标明各实验编号.