题目内容
8.常温下,某工程师以浓硫酸、浓硝酸、粗铜、水和空气为原料,设计如图所示制取硫酸铜晶体(CuSO4•5H2O )的生产工序和流程: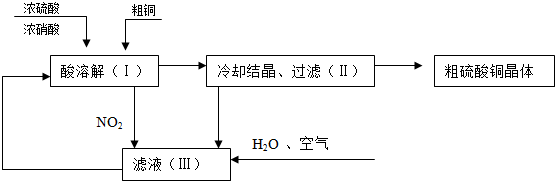
回答下列问题:
(1)写出(Ⅰ)中制取硫酸铜的总反应的化学方程式Cu+2HNO3+H2SO4=CuSO4+2NO2↑+2H2O;
(2)在上述反应中可以被循环利用的物质的化学式为:HNO3或NO2.
(3)①:某同学在实验室中为模拟上述生产过程,实现上述方案,请根据该同学的思路在下列装置中选用适当的装置,并将它们的编号填入方框内:

②装置C的作用是:吸收尾气.
(4)硫酸铜晶体也可以直接用浓硫酸和粗铜反应制取,与上述方法相比,其缺点是:浓硫酸直接和Cu反应需要加热;浓硫酸产生的SO2在此实验中难以循环利用原料利用率低并污染空气.
分析 浓硫酸、浓硝酸和粗铜得到硫酸铜溶液,冷却结晶过滤得到粗硫酸铜晶体,滤液Ⅲ中通入空气、水和二氧化氮生成硝酸,重新循环使用,
(1)Cu与HNO3(浓)反应,只有2molHNO3被还原,另2molH+ 由H2SO4提供,(Ⅰ)中制取硫酸铜的反应为铜和硝酸、硫酸反应生成硫酸铜、二氧化氮和水;
(2)分析流程可知,参与反应过程,最后又生成的物质可以循环使用;
(3)①铜与浓硝酸反应,不要加热,故选A,反应中要被充空气,选 B②装置C的作用是吸收剩余的NO2,防止污染空气;
(4)浓硫酸与Cu直接反应需要加热;浓硫酸产生的SO2在此实验中难以循环利用原料利用率低并污染空气.
解答 解:(1)Cu与HNO3(浓)反应,只有2molHNO3被还原,另2molH+ 由H2SO4提供,(Ⅰ)中制取硫酸铜的反应为铜和硝酸、硫酸反应生成硫酸铜、二氧化氮和水,反应的化学方程式为:Cu+2HNO3+H2SO4═CuSO4+2NO2↑+2H2O,
故答案为:Cu+2HNO3+H2SO4═CuSO4+2NO2↑+2H2O;
(2)上述分析可知,滤液Ⅲ中通入空气和二氧化氮气体反应得到硝酸溶液可以循环使用,和粗铜反应生成二氧化氮气体,所以二氧化氮和硝酸可以循环使用,
故答案为:HNO3 或NO2;
(3)①某同学在实验室中为模拟上述生产过程,实现上述方案,①铜与浓硝酸反应,不要加热,故选A,反应中要被充空气,选 B②装置C的作用是吸收剩余的NO2,防止污染空气,编号填入方框内为: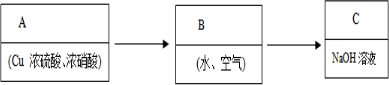
故答案为: ;
;
②装置C中是氢氧化钠溶液,生成的氮氧化物可以通过氢氧化钠溶液吸收,防止污染空气,
故答案为:吸收尾气;
(4)Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,浓硫酸直接和Cu反应需要加热消耗能源,浓硫酸产生的SO2在此实验中难以循环利用,原料利用率低并污染空气;
故答案为:浓硫酸直接和Cu反应需要加热;浓硫酸产生的SO2在此实验中难以循环利用原料利用率低并污染空气;
点评 本题考查了实验室制备硫酸铜的流程分析,反应原理的理解应用,装置选择和实验设计是解题关键,题目难度中等.

| A. | 1mol任何物质都约含有6.02×1023个原子 | |
| B. | 物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4NA | |
| C. | O2的摩尔质量是32 | |
| D. | 摩尔是物质的量的单位 |
| 选项 | 仪器 | 实验 |
| A | 制取蒸馏水 | 圆底烧瓶、冷凝管、锥形瓶、温度计、牛角管 |
| B | 由98%的浓硫酸配制250ml 1.5mol/L的稀硫酸 | 250mol容量瓶、量筒、胶头滴管、玻璃棒 |
| C | 实验室用MnO2与浓盐酸制取并收集氯气 | 酒精灯、铁架台(带铁夹、铁圈)、圆底烧瓶、导管、集气瓶 |
| D | 测定NaCl中混有KCl | 烧杯、玻璃棒、酒精灯、蓝色钴玻璃、铂丝 |
| A. | A | B. | B | C. | C | D. | D |
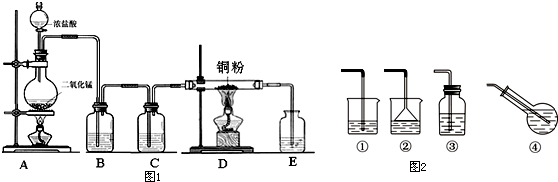
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移情况:
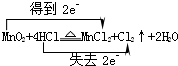 .
.(2)B瓶盛放的试剂是饱和食盐水(填名称),其作用是除去HCl;C瓶盛放的试剂是浓硫酸(填名称),其作用是干燥Cl2;
(3)实验开始时,应首先检验装置的气密性;实验结束应先熄灭D处的酒精灯;
(4)写出D处管内反应的化学方程式:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;
Ⅱ、(1)若制备饱和氯水,图2吸收装置中最佳的选择是④;
(2)用滴管将新制氯水慢慢滴入含酚酞的NaOH溶液中,当滴到最后一滴时,红色褪去.产生上述现象的可能原因有两种:①氯水显酸性,NaOH溶液被中和而褪色;②氯水中的HClO将酚酞氧化而褪色.请你帮他设计实验证明红色褪去的原因是①还是②.
| 实验操作 | 实验现象 | 结 论 |
| 向已褪色的溶液中加入适量NaOH溶液 | 溶液变红 | 假设①成立 |
| 溶液不变红 | 假设②成立 |
| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(A)/mol | 0.4 | 0.8 | 0.8 |
| n(B)/mol | 0.24 | 0.24 | 0.48 | |
| A的平衡转化率 | 80% | α1 | α2 | |
| A. | 甲从开始到平衡时ν(A)为0.032mol•L-1•min-1 | |
| B. | 平衡时,A的转化率:α1<80%<α2 | |
| C. | T℃时,平衡常数K=400L/mol | |
| D. | 绝热容器中,压缩体积,平衡常数K>400 L/mol |
 甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:CO(g)+2H2(g)?CH3OH (g)
(1)在容积固定为2L的密闭容器内充入1mol CO和2mol H2,加入 催化剂后在250℃开始反应,CO的平衡转化率与温度、压强的关系如图所示.
容器中M、N两点气体的物质的量之比为5:4.
M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ.
(2)通过压力计监测上述容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(3)下列描述中能说明上述反应已达平衡状态的是BC.
A.2v(H2)正=v(CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成2n mol H2
(4)25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解300mL NaCl溶液,正极反应式为O2+4 H++4 e-=2 H2O.在电解一段时间后,NaCl溶液的pH变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为0.005mol.
| A. | 12种 | B. | 10种 | C. | 8种 | D. | 14种 |