6.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110-120℃时,失去结晶生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+,防止Co2+转化为Co(OH)2沉淀.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+,防止Co2+转化为Co(OH)2沉淀.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
5.如图是三种稀酸对Fe-Cr合金的腐蚀性随Cr含量变化的实验结果,下列有关说法正确的是( )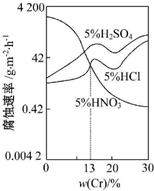

| A. | 稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱 | |
| B. | 随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱 | |
| C. | Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 | |
| D. | 稀硝酸和铁反应的化学方程式:Fe+6HNO3(稀)=Fe(NO3)3+3NO2↑+3H2O |
4.下列说法不正确的是( )
| A. | 镁铝合金密度较小、强度高,常用作制造航天器的材料 | |
| B. | 能自发进行的化学反应,可能是△H>0、△S>0 | |
| C. | CaC2着火时可使用泡沫灭火器灭火 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
2.一定条件下,K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O,则下列判断正确的是( )
| A. | 生成0.3 mol Cl2时,转移电子的物质的量为0.6 mol | |
| B. | 该反应中,生成的Cl2的摩尔质量约为70.7 g/mol | |
| C. | 被0.1 mol K37ClO3氧化的H35Cl的物质的量为0.6 mol | |
| D. | 该反应中,H35Cl发生氧化反应,KCl是还原产物 |
1.设NA为阿伏加德罗常数的值.则下列说法不正确的是( )
| A. | 4.6g 金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA | |
| B. | 1 L 0.5 mol/L 的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA | |
| C. | 过量的Fe与1 mol Cl2充分反应,转移电子的数目为2NA | |
| D. | 1 L含NA个Al3+的Al(NO3)3溶液中,NO3-物质的量浓度大于3 mol/L |
20.在Al(NO3)3和NaHSO4的混合溶液,能够大量共存的粒子组是( )
| A. | Ba2+、OH-、Mg2+、Cl- | B. | Fe2+、SO32-、Cu2+、AlO2- | ||
| C. | HCO3-、I-、Cl-、Cu2+ | D. | Fe3+、Cu2+、Cl-、H+、 |
19.下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
| A. | 生石灰、漂白粉、氯化铜、碳酸钠 | B. | 胆矾、盐酸、铁、碳酸钙 | ||
| C. | 蒸馏水、氨水、碳酸氢钠、二氧化硫 | D. | 纯盐酸、空气、硫酸、干冰 |
18.下列有关实验说法不正确的是( )
0 172082 172090 172096 172100 172106 172108 172112 172118 172120 172126 172132 172136 172138 172142 172148 172150 172156 172160 172162 172166 172168 172172 172174 172176 172177 172178 172180 172181 172182 172184 172186 172190 172192 172196 172198 172202 172208 172210 172216 172220 172222 172226 172232 172238 172240 172246 172250 172252 172258 172262 172268 172276 203614
| A. | 硅酸钠溶液应保存在带橡皮塞的试剂瓶中 | |
| B. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 | |
| C. | 液溴易挥发,在存放液溴的试剂瓶中应加水液封 | |
| D. | 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
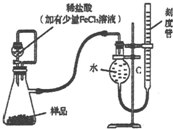 过氧化镁MgO2易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常混有少量MgO,实验室可通过多种方案测定样品过氧化镁的含量.
过氧化镁MgO2易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常混有少量MgO,实验室可通过多种方案测定样品过氧化镁的含量. .
.
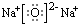 (填写电子式).
(填写电子式).