题目内容
3.(1)对于中学化学常见物质:钠、铁、氧化钠、过氧化钠、二氧化硫、二氧化氮.根据它们在一定条件下能否与H2O发生氧化还原反应进行的分类如下:
请回答下列问题:
①淡黄色固体属于丁(从“甲~丁”选填)组,乙组中物质包括
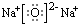 (填写电子式).
(填写电子式).②甲组中的物质能使溴水褪色,其反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-.
③丙组中的某一物质须在高温时才能与水蒸气反应,其化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.另一物质投入足量的Ca(HCO3)2溶液中反应产生气体和沉淀,写出生成沉淀的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,OH-+HCO3-+Ca2+=H2O+CaCO3↓.
(2)用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成.
①Al与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.
②焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是CO2.
③经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为25%.
分析 (1)根据它们在一定条件下能否与水发生氧化还原反应进行分类,钠(Na)、铁(Fe)、氧化钠(Na2O)、过氧化钠(Na2O2)、二氧化硫(SO2)、二氧化氮(NO2)等中学化学常见物质;依据分组后的性质分析判断,甲组、与水反应生成的溶液呈酸性,二氧化硫(SO2)、二氧化氮(NO2);乙组生成物水溶液呈碱性为钠(Na)、氧化钠(Na2O)、过氧化钠(Na2O2);丙组水是氧化剂为:钠(Na)、铁(Fe);丁组与水反应水即不是氧化剂也不是还原剂的是:过氧化钠(Na2O2)、二氧化氮(NO2),据此分析回答问题;
(2)①Al与NaOH溶液反应偏铝酸钠和氢气;
②由药皮的成分和物质的性质进行推断产生的使金属不被氧化的气体成分;
③36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,二氧化硅不和盐酸反应,所以分离得到11.0g的固体是二氧化硅,滤液中加入过量NaOH溶液,分离得到21.4g固体是氢氧化铁,根据铁原子守恒计算氧化铁的质量,剩余的质量就是氧化铝,再根据质量分数公式进行计算.
解答 解:根据它们在一定条件下能否与水发生氧化还原反应进行分类,钠(Na)、铁(Fe)、氧化钠(Na2O)、过氧化钠(Na2O2)、二氧化硫(SO2)、二氧化氮(NO2)等中学化学常见物质;依据分组后的性质分析判断,甲组、与水反应生成的溶液呈酸性,二氧化硫(SO2)、二氧化氮(NO2);乙组生成物水溶液呈碱性为钠(Na)、氧化钠(Na2O)、过氧化钠(Na2O2);丙组水是氧化剂为:钠(Na)、铁(Fe);丁组与水反应水即不是氧化剂也不是还原剂的是:过氧化钠(Na2O2)、二氧化氮(NO2),
(1)①淡黄色固体是过氧化钠,属于丁组物质,B组中物质生成物水溶液呈碱性为Na2O,电子式为: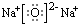 ,故答案为:丁;
,故答案为:丁;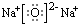 ;
;
②甲组中的物质能使溴水褪色,应为还原性的二氧化硫,其反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-;
故答案为:SO2+Br2+2H2O=4H++SO42-+2Br-;
③丙组中的某一物质须在加热时才能与水蒸气反应为Fe,铁和水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;另一物质投入足量的Ca(HCO3)2溶液中,发生反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,OH-+HCO3-+Ca2+=H2O+CaCO3↓;
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;2Na+2H2O=2Na++2OH-+H2↑,OH-+HCO3-+Ca2+=H2O+CaCO3↓;
(2)①Al与NaOH溶液反应偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
②由药皮的成分大理石、水泥、硅铁可知,在高温下只有大理石才分解产生CO2,因此气体只能是CO2气体,
故答案为:CO2;
③熔渣中只有SiO2与盐酸不反应,因此11.0g是SiO2的质量.Fe2O3、Al2O3溶于盐酸分别生成FeCl3、AlCl3,当滤液中加入过量NaOH溶液时AlCl3生成NaAlO2,FeCl3生成Fe(OH)3沉淀.所以21.4g固体是Fe(OH)3的质量,其物质的量为:$\frac{21.4g}{107g/mol}$=0.2mol,由铁原子守恒知Fe2O3的物质的量为0.1mol,其质量为0.1mol×160g•mol-1=16.0g,
熔渣中Al2O3的质量分数为 $\frac{(36.0-11.0-16.0)g}{36.0g}$×100%=25%,
故答案为:25%.
点评 本题易氧化还原反应为载体考查了元素化合物知识,根据物质的性质分析解答即可,注意过氧化钠中O元素化合价,注意铁和水蒸气反应生成物,这些都是易错点,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 摩尔是一个物理量,含6.02×1023个粒子 | |
| B. | 物质的量是国际单位制的七个基本单位之一 | |
| C. | 摩尔既是物质的量的单位,又是粒子的数量单位 | |
| D. | 摩尔的基准是0.012 Kg 12C中所含的碳原子数 |
| A. | 硅酸钠溶液应保存在带橡皮塞的试剂瓶中 | |
| B. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 | |
| C. | 液溴易挥发,在存放液溴的试剂瓶中应加水液封 | |
| D. | 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
| A. | BaCl2、Ba(NO3)2、NaCl | B. | Ba(NO3)2、KCl、MgCl2 | ||
| C. | Na2CO3、BaCl2、MgCl2 | D. | Na2CO3、K2CO3、NaCl |
 )是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称:酚羟基、醛基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.
)是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称:酚羟基、醛基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.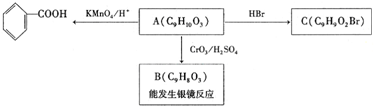
 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型).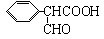 .
.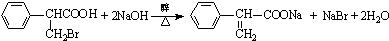 .
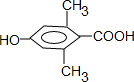
. )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛( )合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
 .
.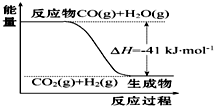 研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:
研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题: