题目内容
18.下列有关实验说法不正确的是( )| A. | 硅酸钠溶液应保存在带橡皮塞的试剂瓶中 | |
| B. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 | |
| C. | 液溴易挥发,在存放液溴的试剂瓶中应加水液封 | |
| D. | 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
分析 A.硅酸钠溶液具有粘性,能将玻璃塞和试剂瓶粘结在一起;
B.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热,利用余热蒸发剩余溶液;
C.溴易挥发,但溴密度大于水;
D.胶体是电中性的分散系.
解答 解:A.硅酸钠溶液具有粘性,能将玻璃塞和试剂瓶粘结在一起,所以硅酸钠溶液应该保存在橡胶塞试剂瓶中,故A正确;
B.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热,利用余热蒸发剩余溶液,故B正确;
C.由于液溴溶于挥发,密度大于水的密度,所以在存放液溴的试剂瓶中应加水封,故C正确;
D.氢氧化铁胶体的胶体粒子带有正电荷,但氢氧化铁胶体呈电中性,故D错误;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及药品贮存、基本操作、胶体性质等知识点,明确物质性质、基本实验操作方法是解本题关键,题目难度不大.

练习册系列答案
相关题目
9.下列实验操作中,正确的是( )
| A. |  燃着的木条检验气体收集满 | B. |  给试管内液体加热 | ||
| C. |  向试管中滴加液体 | D. |  称量氢氧化钠固体质量 |
6.铝、铍(Be)及其化合物具有相似的化学性质,已知:BeCl2+Na2BeO2+2H2O═2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是( )
| A. | Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 | |
| B. | BeCl2水溶液的导电性强,故BeCl2是离子化合物 | |
| C. | Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO | |
| D. | BeCl2溶液的pH>7,将其蒸干并灼烧后得到的残留物可能是BeCl2 |
13.下列关于影响化学反应速率的条件说法正确的是( )
| A. | 增大压强一定能加快化学反应速率 | |
| B. | 使用催化剂,使反应的活化能降低,反应速率加快,平衡右移 | |
| C. | 减小反应物浓度可以减小化学反应速率常数,从而减小化学反应速率 | |
| D. | 升高温度,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快 |
10.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,11.2L CO2所含的原子数为1.5NA | |
| B. | 常温常压下,48g O2含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L H2中所含原子数为NA | |
| D. | 标准状况下,22.4L 四氯化碳的分子数为NA |
7.依据下表判断CH3CH3$\stackrel{一定条件}{→}$CH2=CH2+H2的反应热为( )
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ•mol-1) | 414.4 | 615.3 | 347.4 | 435.3 |
| A. | 125.6kJ•mol-1 | B. | -125.6kJ•mol-1 | C. | 46.1kJ•mol-1 | D. | -46.1kJ•mol-1 |
8.制造玻璃的主要原料为纯碱、石灰石和( )
| A. | 金刚砂 | B. | 石英 | C. | 水玻璃 | D. | 粘土 |

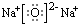 (填写电子式).
(填写电子式).