4.草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+═Mn2++CO2↑+H2O(未配平)用4mL 0.001mol•L-1KMnO4溶液与2mL 0.01mol•L-1H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如表:
(1)该反应中氧化剂和还原剂的物质的量之比为2:5.
(2)如果研究催化剂对化学反应速率的影响,使用实验Ⅰ和Ⅱ(用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ.
(3)对比实验I和IV,可以研究浓度对化学反应速率的影响,实验IV中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H2C2O4)浓度不变和总体积不变.
0 171678 171686 171692 171696 171702 171704 171708 171714 171716 171722 171728 171732 171734 171738 171744 171746 171752 171756 171758 171762 171764 171768 171770 171772 171773 171774 171776 171777 171778 171780 171782 171786 171788 171792 171794 171798 171804 171806 171812 171816 171818 171822 171828 171834 171836 171842 171846 171848 171854 171858 171864 171872 203614
| 实验 | 硫酸(10%)体积/mL | 温度/℃ | 其他物质 |
| I | 2mL | 20 | / |
| II | 2mL | 20 | 10滴饱和MnSO4溶液 |
| III | 2mL | 30 | / |
| IV | 1mL | 20 | 1mL蒸馏水 |
(2)如果研究催化剂对化学反应速率的影响,使用实验Ⅰ和Ⅱ(用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ.
(3)对比实验I和IV,可以研究浓度对化学反应速率的影响,实验IV中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H2C2O4)浓度不变和总体积不变.
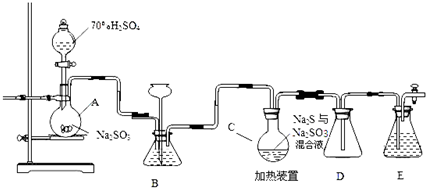
 实验室中按照一定顺序混合2mL浓硫酸、3mL乙醇、2mL乙酸后加热制备乙酸乙酯,将产生的蒸汽经导管通到饱和碳酸钠溶液的液面上(如图所示).
实验室中按照一定顺序混合2mL浓硫酸、3mL乙醇、2mL乙酸后加热制备乙酸乙酯,将产生的蒸汽经导管通到饱和碳酸钠溶液的液面上(如图所示).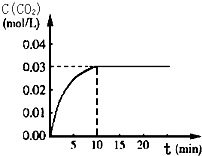 向某一容积为5L的密闭容器中,加入 0.2mol CO和0.2mol H2O,在800℃和催化剂存在的条件下,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化关系如图所示:
向某一容积为5L的密闭容器中,加入 0.2mol CO和0.2mol H2O,在800℃和催化剂存在的条件下,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化关系如图所示: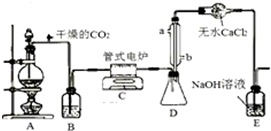

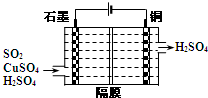 二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料.
二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料.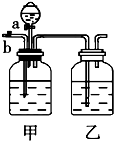 实验室用下列反应制取CO2和CO:H2C2O4$\stackrel{浓硫酸}{→}$CO2+CO+H2O,然后用如图所示装置将CO2和CO进行分离和干燥,已知分液漏斗中为稀硫酸,甲瓶中为NaOH溶液.试回答下列各题:
实验室用下列反应制取CO2和CO:H2C2O4$\stackrel{浓硫酸}{→}$CO2+CO+H2O,然后用如图所示装置将CO2和CO进行分离和干燥,已知分液漏斗中为稀硫酸,甲瓶中为NaOH溶液.试回答下列各题: