题目内容
1.某温度时,在1.0L密闭容器内加入 2.0mo1SO2和1.0mo1O2,发生反应:2SO2(g)+O2(g)?2SO3(g)
请回答:
(1)反应进行2min后,测得SO2为1.4mol,则2min内v(SO3)=0.3mol/(L•min).
(2)若升高温度能使化学平衡向逆反应方向移动,则正反应是放热(填“放热”或“吸热”)反应.
(3)反应进行8min后达平衡,测得c(SO3)=8c(O2),则SO2的平衡转化率是80%.
(4)该温度下,此反应的平衡常数K的表达式为K=$\frac{c{\;}^{2}(SO{\;}_{3})}{c{\;}^{2}(SO{\;}_{2})•c(O{\;}_{2})}$,在该温度下K的数值是80.
分析 (1)根据题中反应物初始的物质的量计算出反应物浓度,再根据2min时二氧化硫的物质的量计算出二氧化硫的浓度,计算出二氧化硫的浓度变化,计算出用二氧化硫表示的速率,根据速率关系计算三氧化硫表示的速率;
(2)升高温度,平衡向吸热反应方向移动,因升高温度能使化学平衡向逆反应方向移动,据此分析;
(3)设氧气的浓度变化为x,列出化学平衡的三段式,根据c(SO3)=8c(O2)列方程计算,再通过二氧化硫的转化率公式进行计算;
(4)根据平衡常数的表达式及达到平衡时各组分的浓度计算出该反应的平衡常数.
解答 解:(1)1L密闭容器中充入物质浓度为:c(SO2)=$\frac{2mol}{1L}$=2mol/L,c(O2)=1mol/L,2min时:c(SO3)=$\frac{1.4mol}{1L}$=1.4mol/L,
v(SO2)=$\frac{2mol/L-1.4mol/L}{2min}$=0.3mol/(L•min),根据速率之比等于化学计量数之比,v(SO3)=v(SO2)=0.3mol/(L•min),
故答案为:0.3;
(2)升高温度,平衡向吸热反应方向移动,因升高温度能使化学平衡向逆反应方向移动,故逆反应为吸热,故正反应为放热反应,故答案为:放热;
(3)设氧气的浓度变化为x,则1L密闭容器在8min内各物质浓度发生的变化如下:
2SO2(g)+O2(g)═2SO3(g),
起始浓度(mol/L) 2 1 0
变化浓度(mol/L) 2x x 2x
平衡浓度(mol/L) 2-2x 1-x 2x
根据:c(SO3)=8c(O2),得:2x=8(1-x),解得x=0.8,
则:SO2的转化率=$\frac{2×0.8}{2}$×100%=80%,
故答案为:80%;
(4)根据(3)的计算,则平衡时c(SO3)=1.6mol/L,c(SO2)=2-1.6=0.4mol/L,c(O2)=1-0.8=0.2mol/L,该反应的平衡常数为K=$\frac{c{\;}^{2}(SO{\;}_{3})}{c{\;}^{2}(SO{\;}_{2})•c(O{\;}_{2})}$=$\frac{1.6{\;}^{2}}{0.4{\;}^{2}×0.2}$=80,
故答案为:K=$\frac{c{\;}^{2}(SO{\;}_{3})}{c{\;}^{2}(SO{\;}_{2})•c(O{\;}_{2})}$;80.
点评 本题考查了化学平衡的计算,题目难度中等,主要涉及了转化率的计算、化学平衡常数的计算,试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用所学知识解决实际问题的能力.

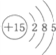 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该原子位于第三周期,ⅤA族 | B. | 该原子位于第五周期,ⅢB族 | ||
| C. | 该原子位于第三周期,ⅤB族 | D. | 该原子位于第五周期,ⅢA族 |
①0.50g锌+5 mL 3 mol/L 硫酸;
②0.50g锌+5 mL 3 mol/L 硫酸+0.1g铜片;
③0.50g锌+5 mL 3 mol/L 硫酸+0.1g铜粉;
④0.50g锌+5 mL 3 mol/L 硫酸+0.39g胆矾(相当于0.1g铜).
下列说法不正确的是( )
| A. | 生成氢气的速率从快到慢为④③②① | |
| B. | 四组实验反应完全后生成氢气的总量相等 | |
| C. | 四组实验反应完全后锌均无剩余 | |
| D. | 四组实验反应完全后所得的硫酸锌的物质的量相同 |



 如图是三种类别的烃CnH m分子中碳原子数n(C原子)与含碳量C%的关系.
如图是三种类别的烃CnH m分子中碳原子数n(C原子)与含碳量C%的关系.