题目内容
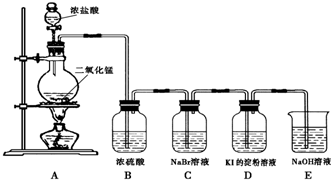
19.某研究性学习小组为探究模拟工业制备硫酸的方法,设计如图所示的一系列装置,根据所示装置回答下列问题:
(1)甲组探究SO3的生成,主要设计如下的发生装置:
①装置A中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
②实验过程中,当V2O5表面红热后,应将酒精灯移开一会儿后再继续加热,其原因是该反应的正反应放热,温度过高平衡向逆反应方向移动,不利于三氧化的生成.
(2)乙组探究工业上为何采用98.3%的浓硫酸吸收三氧化硫而设计如图所示装置:(前面装置与甲组装置相同)
①装置D和E的作用是:吸收SO3并做对照实验.
②E装置在反应过程中出现气泡,不久就出现了白雾,而D装置一直没有明显变化,产生这种现象的可能原因是:a、D中插入浓硫酸溶液的导管插得较深,使两个吸收瓶内的压强差较大,而导致SO3从E的水中冒了出来,与水形成酸雾;
b、浓硫酸对SO3的吸收效果远好于水,SO3充分被浓硫酸吸收
(3)丙组则探究的是二氧化硫的转化率,而设计图丙所示装置:(前面装置与甲组相同)
①F锥形瓶中盛放的溶液可以是(选填序号)c
a、足量澄清石灰水
b、足量小苏打溶液
c、足量氯化钡溶液
d、足量硝酸钡溶液
②反应停止后,要通过装置F锥形瓶中产生的白色沉淀的量测定已被氧化的二氧化硫的量时,在滤出沉淀前必须进行一步实验操作是(简述过程)
分析 (1)根据甲组图中有关试剂可知,用浓硫酸与亚硫酸钠反应生成二氧化硫,在B装置中通入氧气,干燥后得氧气和二氧化硫混合气体,经过C装置,在五氧化二钒的作用下生成三氧化硫,该反应为放热反应,根据温度对平衡的影响答题;
(2)①装置D和E可以吸收三氧化硫同时还可以比较浓硫酸、水分别吸收三氧化硫的情况;
②若E装置在反应过程中出现气泡,不久就出现了白雾,而D装置一直没有明显变化,可能是D中插入浓硫酸溶液的导管插得较深,使两个吸收瓶内的压强差较大,而导致SO3从E的水中冒了出来,与水形成酸雾也可能是浓硫酸对SO3的吸收效果远好于水,SO3充分被浓硫酸吸收;
(3)根据丙组图可知,在前面产生的混合气体中有SO2、SO3、O2,经过F装置冷却,吸收SO3,F中可以装氯化钡溶液,因为SO3与氯化钡能产生沉淀,而二氧化硫与氯化钡没有反应,G中的氢氧化钠吸收二氧化硫,F中的氢氧化钠防止空气中的二氧化碳等对实验的干扰,据此答题.
解答 解:(1)根据甲组图中有关试剂可知,用浓硫酸与亚硫酸钠反应生成二氧化硫,在B装置中通入氧气,干燥后得氧气和二氧化硫混合气体,经过C装置,在五氧化二钒的作用下生成三氧化硫,该反应为放热反应,根据温度对平衡的影响答题,
①根据上面的分析可知,装置A中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
②合成三氧化硫的反应为放热反应,升高温度平衡逆向移动,三氧化硫的产率降低,所以反应过程中温度不能过高,
故答案为:该反应的正反应放热,温度过高平衡向逆反应方向移动,不利于三氧化的生成;
(2)①装置D和E可以吸收三氧化硫同时还可以比较浓硫酸、水分别吸收三氧化硫的情况,
故答案为:吸收SO3并做对照实验;
②若E装置在反应过程中出现气泡,不久就出现了白雾,而D装置一直没有明显变化,可能是D中插入浓硫酸溶液的导管插得较深,使两个吸收瓶内的压强差较大,而导致SO3从E的水中冒了出来,与水形成酸雾也可能是浓硫酸对SO3的吸收效果远好于水,SO3充分被浓硫酸吸收,
故答案为:浓硫酸对SO3的吸收效果远好于水,SO3充分被浓硫酸吸收;
(3)根据丙组图可知,在前面产生的混合气体中有SO2、SO3、O2,经过F装置冷却,吸收SO3,F中可以装氯化钡溶液,因为SO3与氯化钡能产生沉淀,而二氧化硫与氯化钡没有反应,G中的氢氧化钠吸收二氧化硫,F中的氢氧化钠防止空气中的二氧化碳等对实验的干扰,
①根据上面的分析可知,F锥形瓶中盛放的溶液可以是氯化钡溶液,澄清石灰水、小苏打溶液、硝酸钡溶液都是既吸收三氧化硫又吸收二氧化硫,
故选c;
②F装置中吸收三氧化硫的,三氧化硫溶于水生成硫酸根离子,硫酸根离子与钡离子生成硫酸钡,根据硫酸钡的质量可以确定三氧化硫的质量,所以要使溶液中硫酸离子充分沉淀,实验才准确,所以在滤出沉淀前必须进行一步实验操作是静置后向上层清液中滴入氯化钡溶液,若产生沉淀,继续加入氯化钡溶液,重复上述过程至清液中不再产生沉淀,
答:静置后向上层清液中滴入氯化钡溶液,若产生沉淀,继续加入氯化钡溶液,重复上述过程至清液中不再产生沉淀.
点评 本题主要考查工业接触法制硫酸的原理,同时涉及到平衡移动、转化率等,重点考查制备过程中的注意问题和条件的选择依据,注重对知识的综合运用和迁移能力考查,难度中等.

 初中暑期衔接系列答案
初中暑期衔接系列答案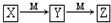 所示转化的是( )
所示转化的是( )| 选项 | X | Y | Z | M |
| A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
| B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
| C | NH3(g) | NO | NO2 | O2 |
| D | S(s) | SO2 | SO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
 某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“酸浸”时所加入的酸是H2SO4 (填化学式).
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1
(5)产品晶体中有时会混有少量绿矾(FeS04•7H20),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(6)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
| 实验 | 硫酸(10%)体积/mL | 温度/℃ | 其他物质 |
| I | 2mL | 20 | / |
| II | 2mL | 20 | 10滴饱和MnSO4溶液 |
| III | 2mL | 30 | / |
| IV | 1mL | 20 | 1mL蒸馏水 |
(2)如果研究催化剂对化学反应速率的影响,使用实验Ⅰ和Ⅱ(用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ.
(3)对比实验I和IV,可以研究浓度对化学反应速率的影响,实验IV中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H2C2O4)浓度不变和总体积不变.
| A. | 用蒸馏水洗净滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 滴定前平视滴定管刻度线,滴定终了俯视刻度线 | |
| D. | 滴定前酸式滴定管尖嘴部分有气泡,滴定终了无气泡 |
| A. | s轨道呈球形,p轨道呈哑铃形 | B. | Cu元素在元素周期表的d区 | ||
| C. | 12g二氧化硅中有0.8NA个Si-O键 | D. | H2O中O原子的杂化方式是sp3 |
| A. | Fe2O3和MnO2 | B. | Fe2O3和V2O5 | C. | Cr2O3和V2O5 | D. | Fe3O4和FeO |