题目内容
5.已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g)═CO2(g)+H2(g)在427℃时的平衡常数是9.如果反应开始时,一氧化碳和水蒸气的浓度都是0.01mol/L,计算一氧化碳在此反应条件下的转化率和一氧化碳的平衡浓度(要求计算过程)
分析 依据化学平衡的三段式列式计算,平衡状态下的物质转化率=$\frac{消耗量}{起始量}$×100%,运用平衡常数的概念列式得到.
解答 解:设一氧化碳的消耗浓度为X,则
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L) 0.01 0.01 0 0
变化量(mol/L) X X X X
平衡量(mol/L) 0.01-X 0.01-X X X
平衡常数K=$\frac{c(H{\;}_{2})•c(CO{\;}_{2})}{c(CO)•c(H{\;}_{2}O)}$=$\frac{X{\;}^{2}}{(0.01-X){\;}^{2}}$=9
解得:X=0.0075mol/L;
一氧化碳转化率=$\frac{0.0075mol/L}{0.01mol/L}$×100%=75%,一氧化碳的平衡浓度为0.01-0.0075=0.0025mol/L;
答:一氧化碳在此反应条件下的转化率75%,一氧化碳的平衡浓度为0.0025mol/L.
点评 本题考查了化学平衡的三段式计算,平衡常数、转化率的概念计算应用,注意平衡常数的计算是用平衡浓度计算,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列“油”中都属于油脂的是( )
①豆油 ②酱油 ③牛油 ④甘油 ⑤汽油.
①豆油 ②酱油 ③牛油 ④甘油 ⑤汽油.
| A. | ①③ | B. | ②④ | C. | ①⑤ | D. | ④⑤ |
20.X、Y、Z和R为原子序数依次递增的四种元素.其中X、Y同周期,X的最高正价是最低负价绝对值的3倍,Y、Z、R同主族,R为人体所需的微量元素.下列说法不正确的是( )
| A. | 127R-的核外含有53电子 | |
| B. | Y、Z、R的氢化物的稳定性逐渐减弱 | |
| C. | Z的单质易挥发,可以水封保存 | |
| D. | 在含有Z单质的水溶液中,通入足量XO2气体,则溶液由黄色变为无色 |
17.能正确表示下列反应的离子反应方程式为( )
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,使沉淀质量达到最大值:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 钠与水的反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
14.我国规定饮用水质量标准必须符合下列要求:
以下是源水处理成自来水的工艺流程示意图
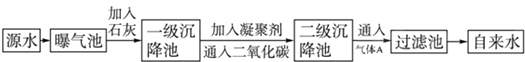
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式:Ca2++HCO-3+OH-=CaCO3↓+H2O,?Mg2++2HCO-3+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,Mg2++2OH-=Mg(OH)2↓..
(2)凝聚剂除去悬浮固体颗粒的过程③(填序号).FeSO4•7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀.
①只是物理过程 ②只是化学过程 ③是物理和化学过程
(3)通入二氧化碳的目的是除去除去Ca2+和调节PH值.
(4)气体A的作用是强氧化.这种作用是基于气体A和水反应的产物具有Cl2+H2O=H++Cl-+HClO性.
(5)下列物质中①③可以作为气体A的代用品.
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
| pH | 6.5~8.5 |
| Ca2+、Mg2+ | <0.004 5mol•L-1 |
| 细菌总数 | <100个/mL |

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式:Ca2++HCO-3+OH-=CaCO3↓+H2O,?Mg2++2HCO-3+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,Mg2++2OH-=Mg(OH)2↓..
(2)凝聚剂除去悬浮固体颗粒的过程③(填序号).FeSO4•7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀.
①只是物理过程 ②只是化学过程 ③是物理和化学过程
(3)通入二氧化碳的目的是除去除去Ca2+和调节PH值.
(4)气体A的作用是强氧化.这种作用是基于气体A和水反应的产物具有Cl2+H2O=H++Cl-+HClO性.
(5)下列物质中①③可以作为气体A的代用品.
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
 ).
).
 .
.