8.医疗上葡萄糖被大量用于病人输液的原因是( )
| A. | 葡萄糖是人体必需的营养素 | |
| B. | 葡萄糖由C.H、O三种元素组成 | |
| C. | 葡萄糖在人体内能直接进入新陈代谢 | |
| D. | 每克葡萄糖被氧化放出的能量值最大 |
7.下列不属于食品添加剂的是( )
| A. | 醋 | B. | 盐 | C. | 料酒 | D. | 鸡蛋 |
5.下列元素的原子在形成不同物质时,既能形成离子键又能形成极性键和非极性键的是( )
| A. | Na | B. | Mg | C. | Cl | D. | Ne |
4.可逆反应2NO2(g)?2NO(g)+O2(g)在体积不变的密闭容器中进行,达到化学平衡的标志是( )
| A. | 单位时间内生成n molO2的同时生成2n mol NO2 | |
| B. | 单位时间内生成n molO2的同时消耗2n mol NO2 | |
| C. | NO2的分解速率等于O2的形成速率 | |
| D. | 反应物和生成物的浓度相等 |
3.下列各组化合物中,化学键类型完全相同的是( )
| A. | CaCl2 和 NaHS | B. | Na2O 和Na2O2 | C. | CO2 和HCl | D. | Na2O2 和NaOH |
2.下列变化中,不需要破坏化学键的是( )
0 171295 171303 171309 171313 171319 171321 171325 171331 171333 171339 171345 171349 171351 171355 171361 171363 171369 171373 171375 171379 171381 171385 171387 171389 171390 171391 171393 171394 171395 171397 171399 171403 171405 171409 171411 171415 171421 171423 171429 171433 171435 171439 171445 171451 171453 171459 171463 171465 171471 171475 171481 171489 203614
| A. | NO与O2反应 | B. | 碘加热升华 | C. | 氯酸钾加热分解 | D. | 氯化钠溶于水 |
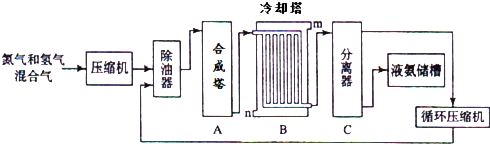
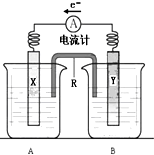 如图是铜锌原电池装置.其电池的总反应是:
如图是铜锌原电池装置.其电池的总反应是: