题目内容
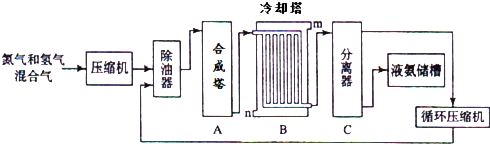
1.铁、铝是现代金属材料的主角.但其腐蚀造成很大的经济损失,寻求金属制品抗腐蚀处理的方法意义重大.(1)一种钢铁防腐的方法是将钢铁放在冷的浓硝酸中浸泡.但是加热或在稀HNO3中,铁与硝酸会不断反应.不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如图1.
①钢铁在冷的浓硝酸中浸泡能防腐的原因是:铁在浓HNO3中会“铁化”在钢铁表面形成一层致密氧化膜.
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是:硝酸易挥发,不稳定,见光易分解,故不易操作,生成物对环境污染严重.
③由图示可知,密度等于1.35g/mL 的硝酸与铁反应时,其还原产物主要是NO2、NO; 请用一句话概括该图2反映出的基本结论硝酸浓度(密度)越大,其还原产物化合价越高.
(2)以下为铝材表面处理的一种方法
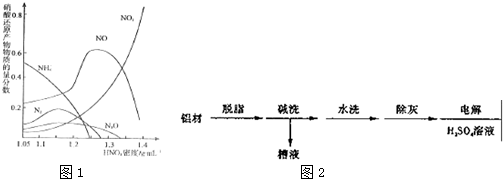
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是2Al+2OH-+2H2O═2AlO+3H2↑(用离子方程式表示).为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的b.
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应为2Al+3H2O-6e-═Al2O3+6H+.电解后的铝材再经氨洗的目的是中和表面的酸溶液.
③取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀.
分析 (1)①冷的浓硝酸具有强的氧化性,铁在浓HNO3中会“钝化”在钢铁表面形成一层致密氧化膜;
②浓硝酸具有易挥发,见光分解,生成产物污染空气等性质;
③根据图象知,该条件下,硝酸主要被还原为NO2、NO,依据硝酸的密度结结合图象分析硝酸还原产物百分含量的变化规律;
(2)①有气泡冒出因2Al+2OH-+2H2O═2AlO2-+3H2↑;因碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或
CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解.
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;根据氨显碱性分析;
③HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀.
解答 解:(1)①浓硝酸具有强的氧化性,铁在浓HNO3中会“钝化”在钢铁表面形成一层致密氧化膜,
故答案为:铁在浓HNO3中会“铁化”在钢铁表面形成一层致密氧化膜;
②工业上一般不用冷浓硝酸进行铁表面处理,浓硝酸具有易挥发,见光分解,生成产物污染空气等性质,
故答案为:硝酸易挥发,不稳定,见光易分解,故不易操作,生成物对环境污染严重;
③从图中可以看出,当其他条件一致时,在浓硝酸(密度等于l.35g•mL-1)中,主要产物NO2、NO,随着硝酸浓度逐渐降低,产物NO2逐渐减少而NO的相对含量逐渐增多;该图反映出的基本结论:硝酸的密度越大、浓度越大,其还原产物中氮元素化合价越高,
故答案为:NO2、NO;硝酸浓度(密度)越大,其还原产物化合价越高;
(2)①铝能与强碱反应产生氢气,Al(OH)3具有两性,既能与强碱反应也能与强酸反应生成盐和水,碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解,
故答案为:2Al+2OH-+2H2O═2AlO+3H2↑;b;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;因为氨显碱性,所以电解后的铝材再经氨洗的目的是中和表面的酸溶液,
故答案为:2Al+3H2O-6e-═Al2O3+6H+;中和表面的酸溶液;
③加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+,和HCO3-发生了互促水解.或HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀,
故答案为:HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀.
点评 本题考查了硝酸的性质,铝的性质,金属的腐蚀及防护知识以及电化学知识等,考查较为综合,做题时注意把握好Al、AlO2-、Al(OH)3等物质的性质,掌握电解等知识的原理,了解金属的防护措施,难度不大,但要注意知识的积累.

| A. | 所得到的分散系属于胶体 | |
| B. | 用一束光照射该分散系时,看不到一条光亮的“通路” | |
| C. | 该分散系不能透过滤纸 | |
| D. | 该分散系的分散质为Fe(OH)3 |

下列说法错误的是( )
| A. | 滤液A中不含Fe3+ | |
| B. | 样品中含氧元素的物质的量为0.01mol | |
| C. | 上图中V=112 | |
| D. | 溶解样品的过程中消耗的硫酸的总的物质的量为0.02mol |
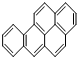
| A. | C20H12 | B. | C20H34 | C. | C22H12 | D. | C30H36 |
| A. | v(C)=0.5mol/(L•s) | B. | v(D)=0.4mol/(L•s) | C. | v(B)=0.6mol/(L•s) | D. | v(A)=9.0mol/(L•min) |
| A. | NH3的电子式: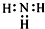 | |
| B. | S2-的结构示意图: | |
| C. | 中子数为146、质子数为92的铀(U)原子${\;}_{92}^{146}$U | |
| D. | 氮气分子的结构式:N-N |
| A. | 升高温度 | B. | 增大压强 | C. | 降低温度 | D. | 改变反应物用量 |
 原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M最外层电子数是电子层数的2倍,N2+核外3d有9个电子,请回答下列问题:
原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M最外层电子数是电子层数的2倍,N2+核外3d有9个电子,请回答下列问题: