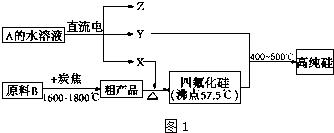
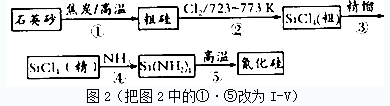
题目内容
5.下列元素的原子在形成不同物质时,既能形成离子键又能形成极性键和非极性键的是( )| A. | Na | B. | Mg | C. | Cl | D. | Ne |
分析 一般来说,活泼金属与非金属形成离子键,同种非金属之间形成非极性共价键,不同非金属元素之间形成极性键,以此来解答.
解答 解:A.形成化合物时,Na只能失去电子,只形成离子键,故A不选;
B.形成化合物时,Mg只能失去电子,只形成离子键,故B不选;
C.Cl与金属可形成离子键,氯气中形成Cl-Cl非极性键,HCl中形成H-Cl极性键,故C选;
D.Ne的最外层电子为稳定结构,一般不能形成化学键,故D不选;
故选C.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
18.某无色透明酸性溶液中,能大量共存的离子组是( )
| A. | Na+、CO32-、Cu2+、SO42- | B. | K+、Fe3+、SO42-、OH- | ||
| C. | Ca2+、NO3-、Cl-、K+ | D. | Ba2+、K+、MnO4-、NO3- |
10.关于蛋白质的下列叙述正确的是( )
| A. | 加热会使蛋白质变性,因此生吃鸡蛋比熟吃好 | |
| B. | 蛋白质水解时直接变成氨基酸 | |
| C. | 一束光线照射蛋白质溶液,产生丁达尔效应 | |
| D. | 蛋白质仅含C、H、O、N四种元素 |
17.在一定条件下,对于密闭容器中进行的反应:N2(g)+3H2(g)?2NH3(g),下列说法能充分说明该反应已达到化学平衡状态的是( )
| A. | N2、H2完全转化为NH3 | B. | N2、H2、NH3的浓度一定相等 | ||
| C. | 正、逆反应速率相等且等于零 | D. | N2、H2、NH3的浓度不再改变 |
12.下列有关水的电离的说法正确的是( )
| A. | 将水加热,KW增大,pH不变 | |
| B. | 向水中加入少量NaHSO4固体,恢复到原温度,水的电离被抑制,C(H+) 增大 | |
| C. | 向水中加入少量NH4Cl固体,恢复到原温度,水的电离程度减小 | |
| D. | 向水中加少量KOH固体,恢复到原温度,水的电离程度增大 |
12.下列说法中,正确的是( )
| A. | 乙烯的摩尔质量为28 | |
| B. | 标准状况下,11.2 L四氯化碳所含分子数为0.5 NA | |
| C. | 1L 0.1mol/L Na2CO3溶液中含CO32-数目为0.1NA | |
| D. | 16g CH4所含电子数目为10NA |

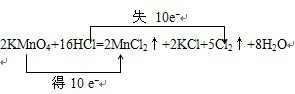
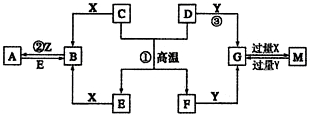
 .
.