1.下列关于热化学反应的描述中正确的是( )
| A. | HCI和NaOH反应的中和热△H=-57.3kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0kJ?mol-1 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
20.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 用含0.lmolFeCl3的溶液与足量沸水反应制得的Fe(0H)3胶体中胶粒数为0.1NA | |
| B. | 46g N02和N204的混合气体中含原子总数为NA | |
| C. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| D. | 0.25 mol Na2O2中含有的阴离子数为0.5 NA |
19.下列有关化学用语使用正确的是( )
| A. | C02的电子式::$\underset{\stackrel{…}{O}}{…}$:$\underset{\stackrel{…}{C}}{…}$:$\underset{\stackrel{…}{O}}{…}$ | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 乙烯的比例模型 | D. | 铝离子结构示意图: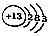 |
16.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 1 L 0.2 mol•L-1硫酸铁溶液中含有的SO42-数为0.2NA | |
| C. | 0.1mol N2与足量的H2反应,转移的电子数为0.6NA | |
| D. | 用惰性电极电解1L0.1mol•L-1 CuCl2溶液,当有0.2NA个电子通过时,可生成6.4g铜 |
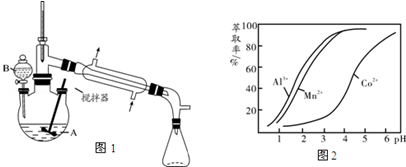
13.实验室制备环己酮的反应原理为: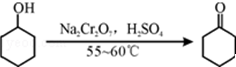 其反应的装置示意图如图1(夹持装置、加热装置略去):环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:
其反应的装置示意图如图1(夹持装置、加热装置略去):环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:
注:括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~60℃进行反应.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物
①仪器B的名称是分液漏斗.
②蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
③蒸馏不能分离环己酮和水的原因是环已酮和水形成具有固定组成的恒沸物一起蒸出.
(2)用漂粉精和冰醋酸代替酸性Na2Cr2O7溶液也可氧化环己醇制环己酮,用漂粉精和冰醋酸氧化突出的优点是避免使用有毒的Na2Cr2O7.
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151~156℃馏分,得到精品 b.过滤
c.在收集到的粗品中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水
①上述操作的正确顺序是c d b a(填序号)
②在上述操作c中,加入NaCl固体的作用是增加水层的密度,有利于分层,减小产物的损失.
(4)环己酮是一种常用的萃取剂,以环己酮为成分之一的萃取液对金属离子的萃取率与pH的关系如图2所示.现有某钴矿石的盐酸浸出液,浸出液含有的阳离子主要有H+、Co2+、Mn2+、Al3+,除去Al3+后,再利用萃取法分离出MnCl2以得到较为纯净的CoCl2溶液,pH范围应控制在b.
a.2.0~2.5 b.3.03.5 c.4.0~4.5.
0 171016 171024 171030 171034 171040 171042 171046 171052 171054 171060 171066 171070 171072 171076 171082 171084 171090 171094 171096 171100 171102 171106 171108 171110 171111 171112 171114 171115 171116 171118 171120 171124 171126 171130 171132 171136 171142 171144 171150 171154 171156 171160 171166 171172 171174 171180 171184 171186 171192 171196 171202 171210 203614
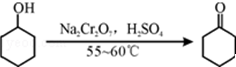 其反应的装置示意图如图1(夹持装置、加热装置略去):环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:
其反应的装置示意图如图1(夹持装置、加热装置略去):环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95) | 0.9478 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.3301 | |
| 水 | 100.0 | 0.9982 |
(1)实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~60℃进行反应.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物
①仪器B的名称是分液漏斗.
②蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
③蒸馏不能分离环己酮和水的原因是环已酮和水形成具有固定组成的恒沸物一起蒸出.
(2)用漂粉精和冰醋酸代替酸性Na2Cr2O7溶液也可氧化环己醇制环己酮,用漂粉精和冰醋酸氧化突出的优点是避免使用有毒的Na2Cr2O7.
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151~156℃馏分,得到精品 b.过滤
c.在收集到的粗品中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水
①上述操作的正确顺序是c d b a(填序号)
②在上述操作c中,加入NaCl固体的作用是增加水层的密度,有利于分层,减小产物的损失.
(4)环己酮是一种常用的萃取剂,以环己酮为成分之一的萃取液对金属离子的萃取率与pH的关系如图2所示.现有某钴矿石的盐酸浸出液,浸出液含有的阳离子主要有H+、Co2+、Mn2+、Al3+,除去Al3+后,再利用萃取法分离出MnCl2以得到较为纯净的CoCl2溶液,pH范围应控制在b.
a.2.0~2.5 b.3.03.5 c.4.0~4.5.





 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等. .
.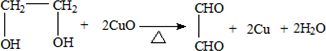 .
. .
.
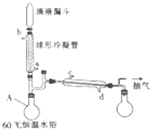 过氧乙酸常用作氧化剂和灭菌剂.实验室合成过氧乙酸并测定其含量的相关步骤如下:
过氧乙酸常用作氧化剂和灭菌剂.实验室合成过氧乙酸并测定其含量的相关步骤如下: