题目内容
17. 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.Ⅰ.制备
碱式碳酸铜因生成条件不同,其颜色和组成也不尽相同,即碱式碳酸铜中Cu(OH)2和CuCO3的比例不同,某实验小组设计以下不同实验制备碱式碳酸铜.
(1)由Na2CO3•10H2O与CuSO4•5H2O反应制备:称取14gCuSO4•5H2O、16gNa2CO3•10H2O,用研钵分别研细后再混合研磨,立即发生反应,有“嗞嗞”声,而且混合物很快成为“黏胶状”,将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀产生,过滤,用水洗涤沉淀,至滤液中不含SO42-为止,取出沉淀,风干,得到蓝绿色晶体.
①混合物发生反应时有“嗞嗞”声的原因是有CO2气体生成,混合物成为“黏胶状”的原因是混合物吸水.
②撤离热源的目的是防止碱式碳酸铜受热分解.
③检验滤液中是否含SO42-的方法是取最后一次洗涤液于试管中,先加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-,否则没有.
(2)由Na2CO3溶液与CuSO4溶液反应制备:分别按一定比例取CuSO4溶液和Na2CO3溶液,水浴加热到设定温度后,在充分振荡下采用将CuSO4溶液加入Na2CO3溶液或将Na2CO3溶液加入CuSO4溶液的加料顺序进行试验,影响产品组成和产率的因素可能有温度、反应物配比、加料顺序(列2点)
Ⅱ.组成测定
有同学查阅资料发现用Cu(OH)2•CuCO3表示碱式碳酸铜是不准确的,较为准确、科学的表达式应该是mCu(OH)2•nCuCO3,不同来源的碱式碳酸铜的m、n值需要具体测定.
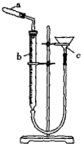
(3)热分解法测定碱式碳酸铜组成的实验装置如图所示,通过测定碱式碳酸铜在灼热后所产生的气体体积,推导出碱式碳酸铜中碳酸铜和氢氧化铜的含量,即可求出m和n的比值.
①仪器c的名称是漏斗.
②检验装置气密性的方法是连接好装置,通过漏斗向装置中加水,至漏斗中水面比量气管中高,静置,水面不发生变化则装置不漏气,否则装置漏气.
③三次平行实验测定结果如下表,计算该样品中m:n=3:2,若量气管中所盛液体为水,则该测定值比理论值偏大(填“偏大”或“偏小”)
| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
分析 (1)①用研钵分别研细后再混合研磨,发生水解反应,有CO2气体生成,产生大量气泡,有“磁磁”的声音,而且混合物吸湿很厉害,很快成为“黏胶状”;
②碱式碳酸铜不稳定,受热容易分解;
③根据SO42-的检验方法:先加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-;
(2)由题目信息可知:产物的组成与反应物配比、加料顺序、温度等有关,从而使碱式碳酸铜中Cu(OH)2和CuCO3的比例不同;
(3)①根据常见仪器的结构写出名称;
②此装置漏斗与大气相通,要进行其气密性检查,首先要考虑的问题是如何使试管不直接通过量气管与大气相通,要解决这一问题,显而易见的用水(或液体)做液封,从而实现这一目的;
③先判断三次平行实验数据的有效性,然后求出平均值,然后根据方程式mCu(OH)2•nCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(m+n)CuO+mH2O+nCO2↑求出$\frac{m}{n}$的值;若量气管中所盛液体为水,二氧化碳溶于水,n值偏小,则m值偏大.
解答 解:(1)①用研钵分别研细后再混合研磨,发生水解反应,有CO2气体生成,产生大量气泡,所以会有“磁磁”的声音,由于混合物易吸水,很快成为“粘胶状,
故答案为:有CO2气体生成;混合物吸水;
②由于碱式碳酸铜受热容易分解,故应迅速撤离热源,防止其分解,
故答案为:防止碱式碳酸铜受热分解;
③滤液中是否含有SO42-的操作方法是:取最后一次洗涤液于试管中,先加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-,否则没有;
故答案为:取最后一次洗涤液于试管中,先加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-,否则没有;
(2)产物的组成与反应物配比、加料顺序、温度等有关,从而使碱式碳酸铜中Cu(OH)2和CuCO3的比例不同,
故答案为:反应物配比、加料顺序;
(3)①仪器c的名称是漏斗;
故答案为:漏斗;
②此装置漏斗与大气相通,要进行其气密性检查,首先要考虑的问题是如何使试管不直接通过量气管与大气相通,具体方法:连接好装置,通过漏斗向装置中加水,至漏斗
中水面比量气管中高,静置,水面不发生变化则装置不漏气,否则装置漏气;
故答案为:连接好装置,通过漏斗向装置中加水,至漏斗中水面比量气管中高,静置,水面不发生变化则装置不漏气,否则装置漏气;
③三次平行实验数据均有效,CO2体积的平均值$\frac{44.82+44.78+44.80}{3}$mL=44.80mL,物质的量为$\frac{0.0448L}{22.4L/mol}$=0.002mol,
mCu(OH)2•nCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(m+n)CuO+mH2O+nCO2
(98m+124n)g nmol
0.542g 0.002mol
$\frac{98m+124n}{0.542}$=$\frac{n}{0.002}$ 解得:m:n=3:2;
若量气管中所盛液体为水,二氧化碳溶于水,n值偏小,则m值偏大,m与n的比值偏大;
故答案为:3:2;偏大.
点评 本题考查物质的制备与组成测定,侧重对实验现象的分析、问题讨论的考查,综合考查学生对知识的迁移应用,难度中等.

 名校课堂系列答案
名校课堂系列答案他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
[实验操作]将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质.
[提出假设]
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3.
假设3:白色物质是Na2O和Na2CO3的混合物.
[设计方案]该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液. ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀. ②无明显现象 | 白色物质为Na2CO3 |
(1)写出金属镁与二氧化碳反应的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(2)甲同学认为方案1得到的结论不正确,其理由是因为碳酸钠水解生成的氢氧化钠使溶液呈碱性,也能使酚酞试液变红色.
(3)钠在二氧化碳中燃烧的化学方程式为4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.
(4)乙同学认为白色物质有可能是氢氧化钠.你是否同意乙同学的观点,并简述理由:不同意,反应物是钠和二氧化碳,仅三种元素,没有氢元素.
a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
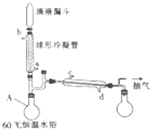
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究,实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是控制分液漏斗的活塞,使浓硫酸缓慢滴入A中.
(4)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是A中反应一会生成二氧化硫,C中才能反应.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(5)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.100 0mol•L-1碘的标准溶液,至溶液呈紫色不再褪去,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2S、Na2CO3, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O${\;}_{3}^{2-}$+I2═S4O${\;}_{6}^{2-}$+2I- 产品纯度:$\frac{9}{w}$×100%. |
| A. | 加入铝粉能产生H2的溶液中,一定存在大量的Na+,Ba 2+,AlO2-,NO3- | |
| B. | SiO2与酸,碱均不反应 | |
| C. | NO2溶于水时发生氧化还原反应 | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
| 『资料』 | 溴水是溴单质的水溶液,因溶有溴单质而呈黄色. |
(1)提出问题猜想:
猜想Ⅰ:溶液呈黄色是因发生离子反应①2Fe2++Cl2=2Fe3++2Cl-( 填离子方程式)所致.
猜想Ⅱ:溶液呈黄色是因发生离子反应②2Br-+Cl2=Br2+2Cl-( 填离子方程式)所致.
(2)设计实验并验证:
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
所给试剂:酚酞试液、CCl4、无水酒精、KSCN溶液
方案1:取所述黄色溶液于试管中,滴加KSCN并振荡,溶液变红色;则溶液变黄色由反应①所致.
方案2:取所述黄色溶液于试管中,滴加CCl4并振荡;实验现象为CCl4层(下层)无色.
(3)实验结论:
以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br-
强(填“强”或“弱”).
(4)实验反思:
Ⅰ.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是溶液分层,上下层均为黄色.
Ⅱ.在100mLFeBr2溶液中通入2.24LCl2(标准状况下),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.

命名该化合物时,主链上的碳原子数是( )
| A. | 9 | B. | 1 0 | C. | 12 | D. | 13 |
 过氧乙酸常用作氧化剂和灭菌剂.实验室合成过氧乙酸并测定其含量的相关步骤如下:
过氧乙酸常用作氧化剂和灭菌剂.实验室合成过氧乙酸并测定其含量的相关步骤如下:
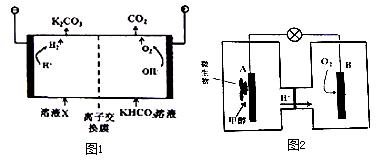 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.