题目内容
19.下列有关化学用语使用正确的是( )| A. | C02的电子式::$\underset{\stackrel{…}{O}}{…}$:$\underset{\stackrel{…}{C}}{…}$:$\underset{\stackrel{…}{O}}{…}$ | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 乙烯的比例模型 | D. | 铝离子结构示意图: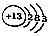 |
分析 A.二氧化碳中存在两个碳氧双键,碳原子和氧原子最外层都达到8电子稳定结构;
B.中子数为20的氯原子的质量数为37;
C.乙烯分子为平面结构,碳原子相对体积大于氢原子;
D.铝离子的核外电子总数为10,最外层达到8电子稳定结构.
解答 解:A.二氧化碳为共价化合物,分子中存在碳氧双键,二氧化碳正确的电子式为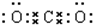 ,故A错误;
,故A错误;
B.氯原子的核电荷数为17,中子数为20的氯原子的质量数为37,该原子正确的表示方法为:1737Cl,故B错误;
C.乙烯分子中含有1个碳碳双键和4个碳氢键,乙烯的比例模型为: ,故C正确;
,故C正确;
D.铝离子的核电荷数为13,最外层为8个电子,铝离子正确的离子结构示意图为: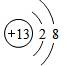 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的判断,题目难度中等,涉及离子结构示意图、比例模型、元素符号、电子式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
3.用氢氧化钠固体配制0.10mol/L的氢氧化钠溶液,下列说法中错误的是( )
| A. | 定容时俯视容量瓶刻度线,会造成所配溶液浓度偏大 | |
| B. | 移液时不慎有部分液体溅出,会造成所配溶液浓度偏小 | |
| C. | 称量时托盘上要垫上干净的称量纸 | |
| D. | 定容摇匀后发现液面下降,不应再加蒸馏水 |
4.
| 物质 | 分子数 | 质量/g | 物质的量/mol | 摩尔质量/g•mol-1 |
| O2 | 8.0 | |||
| H2SO4 | 3.01×1023 | |||
| H2O | 0.5 |
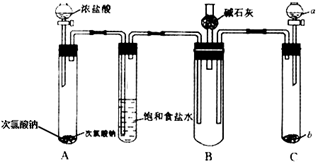
7.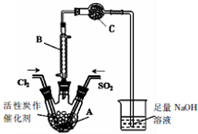 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
(1)若用浓盐酸与二氧化锰为原料制取Cl2,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)C仪器装的药品是无水CaCl2,其作用是防止水蒸气进入A装置(引起SO2Cl2水解);
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl;
(5)实验时选通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收,分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
①经分析SO2Cl2与H2O反应性于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl;
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,如需检验溶液W中这两种阴离子,则其检出第一种离子的检验方法是取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-;
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥、称量得到的固体质量分别为Xg、Yg,则SO2+Cl2?SO2Cl2反应中,SO2的转化率为$\frac{X}{X+Y}$×100%(用含X、Y的代数式表示).
 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.(1)若用浓盐酸与二氧化锰为原料制取Cl2,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)C仪器装的药品是无水CaCl2,其作用是防止水蒸气进入A装置(引起SO2Cl2水解);
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl;
| SO2Cl2 | Cl2 | SO2 | |
| 熔点 | -54.1 | -101 | -72.4 |
| 沸点 | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 |
①经分析SO2Cl2与H2O反应性于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl;
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,如需检验溶液W中这两种阴离子,则其检出第一种离子的检验方法是取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-;
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥、称量得到的固体质量分别为Xg、Yg,则SO2+Cl2?SO2Cl2反应中,SO2的转化率为$\frac{X}{X+Y}$×100%(用含X、Y的代数式表示).
4.用如图所示装置探究碳酸和苯酚的酸性强弱,下列叙述不正确的是(部分夹持仪器省略)( )


| A. | ②中试剂为饱和NaHCO3溶液 | |
| B. | 打开分液漏斗旋塞,①中产生无色气泡,③中出现白色浑浊 | |
| C. | 苯酚的酸性弱于碳酸 | |
| D. | ③中发生反应的化学方程式是 |
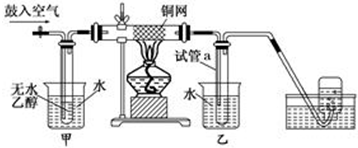
11.将等质量的铜片在酒精灯上加热后,分别插入下列溶液或液体中,放置片刻,取出铜片洗涤干燥,质量和加热前一样的是( )
| A. | 硝酸 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |
9.下列有机物的命名错误的是( )
| A. | 3-甲基-2-戊烯 | B. | 3-甲基-2-丁烯 | C. | 2-乙基丁烷 | D. | 2,2-二甲基丙烷 |