题目内容
20.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 用含0.lmolFeCl3的溶液与足量沸水反应制得的Fe(0H)3胶体中胶粒数为0.1NA | |
| B. | 46g N02和N204的混合气体中含原子总数为NA | |
| C. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| D. | 0.25 mol Na2O2中含有的阴离子数为0.5 NA |
分析 A.氢氧化铁胶粒为氢氧化铁的聚集体;
B.NO2和N2O4的最简式为NO2,根据最简式计算出混合物含有氮原子的物质的量;
C.气体摩尔体积使用对象为气体;
D.过氧化钠是由钠离子和过氧根离子构成分析.
解答 解:A.用含0.lmolFeCl3的溶液与足量沸水反应制得的Fe(0H)3胶体中胶粒数远小于0.1NA,故A错误;
B.46gNO2和N2O4的混合物中含有1mol最简式NO2,含有1mol氮原子,含N原子总数为NA,故B正确;
C.标况下,四氯化碳为液体,不能使用气体摩尔体积,故C错误;
D.过氧化钠是由钠离子和过氧根离子构成,0.25molNa2O2中含有的阴离子数为0.25NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意标况下气体摩尔体积的使用条件和对象,题目难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目
4.下列叙述中正确的是( )
| A. | 标准状况下,1mol任何物质的体积都约为22.4 L | |
| B. | 1mol任何气体所含分子数都相等,体积也都约为22.4L | |
| C. | 相同状况下,1L CO一定比1L O2的质量小 | |
| D. | 在同温同压下,相同体积的任何气体单质所含原子数目相同 |
5.在实验室,往盛有沸水的烧杯中滴加饱和氯化铁溶液可以制得氢氧化铁胶体;在常温下,三氯化铁溶于少量蒸馏水能形成低浓度的氢氧化铁胶体,下列说法不正确的是( )
| A. | 三氯化铁可用作净水剂,是因为氢氧化铁胶体具有吸附性 | |
| B. | 氢氧化铁胶粒直径在10-9一10-7m之间 | |
| C. | 氯化铁溶液转变成氢氧化铁胶体是化学变化,氢氧化铁胶体变成氢氧化铁沉淀是物理变化 | |
| D. | 氢氧化铁胶体的分散质是氢氧化铁分子,分散剂是水 |
5.随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了防止食品受潮常放入硅胶;为了防止食品氧化变质,应放入的是( )
| A. | 无水硫酸铜 | B. | 硫酸亚铁 | C. | 食盐 | D. | 生石灰 |
12.从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( )
| A. |  放出碘的苯溶液 | B. |  分离碘并回收苯 | ||
| C. |  将海带灼烧成灰 | D. | 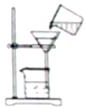 过滤的含I-溶液 |
9.A在一定温度下有分解反应A(s)═B(s)+C(g)+4D(g).若测得生成的气体的质量是同温同压下,相同体积氢气的10倍,且当所生成的气体在标况下的体积为22.4L时,所得B的质量为30.4g,A的摩尔质量为
( )
( )
| A. | 120.4g/mol | B. | 50.4g/mol | C. | 182.4g/mol | D. | 252g/mol |
10.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 常温常压下,18g NH4+所含的电子数为10NA | |
| B. | 56g金属铁与足量的稀盐酸反应时转移的电子数为3NA | |
| C. | 标准状况下,22.4L氧气所含的氧原子数为2 NA | |
| D. | 1 mol由Na2O2和Na2O组成的混合物,其中的钠离子数为4 NA |
 .
. .
. .
.