题目内容
16.设NA为阿伏加德罗常数的值.下列叙述正确的是( )| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 1 L 0.2 mol•L-1硫酸铁溶液中含有的SO42-数为0.2NA | |
| C. | 0.1mol N2与足量的H2反应,转移的电子数为0.6NA | |
| D. | 用惰性电极电解1L0.1mol•L-1 CuCl2溶液,当有0.2NA个电子通过时,可生成6.4g铜 |
分析 A.质量计算物质的量,结合甲基中所含中子数计算判断;
B、依据硫酸铁分子式计算;
C、氮气与氢气的反应为可逆反应,据此分析即可;
D、用惰性电极电解氯化铜,溶液中铜离子放电,有0.2NA个电子通过时,可生成6.4g铜.
解答 解:A.17g甲基(-14CH3)物质的量=$\frac{17g}{(14+3)g/mol}$=1mol,含中子数为14-6+(1-1)×3=8mol,故A错误;
B.硫酸铁的分子式为:Fe2(SO4)3,故1L0.2mol/L的硫酸铁中硫酸根的物质的量=0.2mol×3=0.6mol,故B错误;
C.氮气与氢气的反应为可逆反应,此反应不能进行到底,即0.1mol氮气不能全部反应,故C错误;
D.电解氯化铜溶液,有0.2NA个电子通过时,可生成6.4g铜,故D正确,故选D.
点评 本题主要考查的是阿伏伽德罗常数的应用以及电解原理,涉及化学式的判断和可逆反应,难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目
1.氯水成分的实验探究如下:
(1)指出实验①的结论氯水中含有Cl-.
(2)指出实验②和实验④中的实验现象:②溶液褪色;④有气泡冒出.
(3)实验③中“实验方法”的具体操作过程是:取一小片KI淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上.
(4)若实验中使用的是久置的氯水,实验方法不变,对上述①④实验无影响.
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ② | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | 氯水中含有Cl- |
| ② | 将氯水滴加到含有酚酞的NaOH溶液中 | 溶液褪色 | |
| ③ | 取一小片KI淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上 | 淀粉-KI试纸变蓝色 | 氯水中含有Cl2 |
| ④ | 将足量的氯水滴加到Na2CO3溶液中 | 出现气泡 | 氯水中含有H+ |
(2)指出实验②和实验④中的实验现象:②溶液褪色;④有气泡冒出.
(3)实验③中“实验方法”的具体操作过程是:取一小片KI淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上.
(4)若实验中使用的是久置的氯水,实验方法不变,对上述①④实验无影响.
1.下列关于热化学反应的描述中正确的是( )
| A. | HCI和NaOH反应的中和热△H=-57.3kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0kJ?mol-1 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
8.下列叙述正确的是( )
| A. | 甲醇(CH3OH)和乙醇互为同系物 | |
| B. | 不同元素的原子构成的分子只能含极性共价键 | |
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是中子数不同质子数相同的同种核素 | |
| D. | 短周期第IVA与VIIA族元素的原子间构成的分子,均不满足原子最外层8电子结构 |
6.标准状况下,1mol某种醇能与足量的钠反应生成22.4L氢气,则该醇可能是( )
| A. | CH3OH | B. | CH3CH2OH | C. | 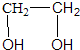 | D. | 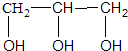 |
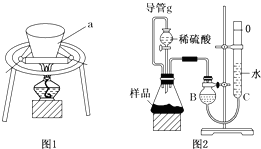 小苏打长期放置在空气中会变质(部分转变为Na2CO3),某研究小组欲测定某小苏打样品中NaHCO3的质量分数,设计如下实验方案:
小苏打长期放置在空气中会变质(部分转变为Na2CO3),某研究小组欲测定某小苏打样品中NaHCO3的质量分数,设计如下实验方案:
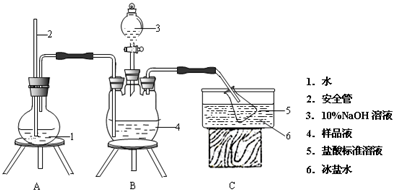
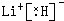 .
.