14.下列混合物分离(或除杂)的方法正确的是( )
| A. | Na2SO4溶液中混有少量CuSO4的杂质可用适量的KOH除去 | |
| B. | Na2CO3固体中含有少量NaHCO3杂质可用加热的方法提纯 | |
| C. | Fe(NO3)3中混有少量Fe(NO3)2的杂质可加入适量的氯水除去 | |
| D. | 可以用分液的方法分离CCl4和水 |
13.化学是一门以实验为基础的学科,请完成下列有关实验问题.
Ⅰ.如图是实验室中制备气体或验证气体性质的装置图
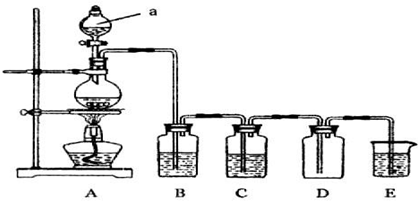
(1)写出用A制取氯气的化学方程式MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O.
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+,则装置B中的溶液的作用是除去氯气中的氯化氢;装置D中加的最佳试剂是(填序号)c:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在如图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
此时,B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的酸性高锰酸钾(填溶液名称),E中加入Na2SiO3溶液(填化学式).
(4)证明碳元素的非金属性比硅元素的强的现象为D中高锰酸钾溶液不褪色,E中溶液变浑浊;
实验2不严谨之处应如何改进将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥管.
Ⅱ、向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色.反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告.
限选试剂:2mol/LHCl,1mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水.
Ⅰ.如图是实验室中制备气体或验证气体性质的装置图

(1)写出用A制取氯气的化学方程式MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O.
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+,则装置B中的溶液的作用是除去氯气中的氯化氢;装置D中加的最佳试剂是(填序号)c:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在如图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
此时,B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的酸性高锰酸钾(填溶液名称),E中加入Na2SiO3溶液(填化学式).
(4)证明碳元素的非金属性比硅元素的强的现象为D中高锰酸钾溶液不褪色,E中溶液变浑浊;
实验2不严谨之处应如何改进将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥管.
Ⅱ、向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色.反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告.
限选试剂:2mol/LHCl,1mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水.
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色. | 溶液分层,下层呈橙红色,证明待测液中含Br-. |
| 步骤② | 在试管B中加入少量待测液,加入过量的2mol/L盐酸,再滴加1mol/L BaCl2溶液 | 有白色沉淀生成, 证明待测液中含SO42-. |
| 步骤③ | 在试管C中加入少量待测液,滴加2mol/LHCl至溶液呈酸性,加入几滴新制饱和溴水(填试剂),振荡. | 溴水褪色, 证明待测液中含SO32-. |
10.具有下列价电子数的原子,最难形成离子的是( )
| A. | L层6个 | B. | L层4个 | C. | M层2个 | D. | M层7个 |
7.下面叙述中正确的是( )
| A. | 1mol冰中有4NA个氢键 | |
| B. | 12克石墨中C---C键为2NA | |
| C. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有6个 | |
| D. | 六方最密堆积中,每个原子的配位数是12 |
6.将agFe2O3和Al2O3的样品溶解在过量的200mL物质的量浓度为0.05mol/L的H2SO4溶液中,然后向其中加入NaOH溶液使Al3+、Fe3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
0 170938 170946 170952 170956 170962 170964 170968 170974 170976 170982 170988 170992 170994 170998 171004 171006 171012 171016 171018 171022 171024 171028 171030 171032 171033 171034 171036 171037 171038 171040 171042 171046 171048 171052 171054 171058 171064 171066 171072 171076 171078 171082 171088 171094 171096 171102 171106 171108 171114 171118 171124 171132 203614
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.4 mol/L | D. | 0.6mol/L |
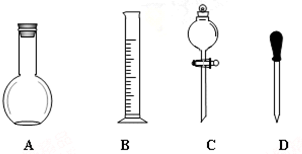 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.