题目内容
13.化学是一门以实验为基础的学科,请完成下列有关实验问题.Ⅰ.如图是实验室中制备气体或验证气体性质的装置图
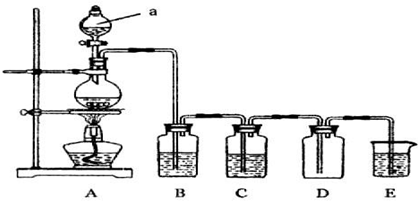
(1)写出用A制取氯气的化学方程式MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O.
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+,则装置B中的溶液的作用是除去氯气中的氯化氢;装置D中加的最佳试剂是(填序号)c:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在如图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
此时,B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的酸性高锰酸钾(填溶液名称),E中加入Na2SiO3溶液(填化学式).
(4)证明碳元素的非金属性比硅元素的强的现象为D中高锰酸钾溶液不褪色,E中溶液变浑浊;
实验2不严谨之处应如何改进将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥管.
Ⅱ、向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色.反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告.
限选试剂:2mol/LHCl,1mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水.
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色. | 溶液分层,下层呈橙红色,证明待测液中含Br-. |
| 步骤② | 在试管B中加入少量待测液,加入过量的2mol/L盐酸,再滴加1mol/L BaCl2溶液 | 有白色沉淀生成, 证明待测液中含SO42-. |
| 步骤③ | 在试管C中加入少量待测液,滴加2mol/LHCl至溶液呈酸性,加入几滴新制饱和溴水(填试剂),振荡. | 溴水褪色, 证明待测液中含SO32-. |
分析 装置A制备氯气,氯气中含有HCl,H2O,通过饱和食盐水除去氯化氢,通过浓硫酸干燥氯气,氯气比空气重,向上排空气方法收集,剩余气体通过氢氧化钠溶液吸收,防止污染空气,
(1)依据实验室制备氯气的反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
(2)依据氯气含有氯化氢分析装置B的作用,铁离子使硫氰化钾溶液变红色分析;
(3)根据元素的非金属性越强,最高价氧化物对应的水化物酸性越强,利用强酸制弱酸来比较酸性强弱,根据CO2中混有二氧化硫,二氧化硫也能与硅酸钠溶液反应,需要酸性高锰酸钾溶液除去;
(4)根据CO2中混有二氧化硫,二氧化硫也能与硅酸钠溶液反应,需要酸性高锰酸钾溶液除去并再次通过酸性高锰酸钾溶液是否除尽;空气中含有二氧化碳,可能干扰实验,故应排除空气中二氧化碳的干扰;
Ⅱ、①利用萃取后,溴溶解在四氯化碳中,下层为橙红色,鉴定Br-;
②加盐酸先排除亚硫酸离子,再利用硫酸钡白色沉淀的生成鉴定SO42-;
③利用溴水与亚硫酸根离子的氧化还原反应,鉴定SO32-.
解答 解:Ⅰ、(1)制备氯气是利用装置加热生成,试剂是二氧化锰和浓盐酸加热反应生成,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)氯气中含有氯化氢气体,通过装置B饱和食盐水可以吸收氯化氢,含亚铁离子的物质被氯气氧化成铁离子使硫氰化钾变红色来来证明Cl2>Fe3+,因此选KSCN与FeCl2的混合溶液,
故答案为:除去氯气中的氯化氢;c;
(3)元素的非金属性越强,最高价氧化物对应的水化物酸性越强,利用碳酸的酸性强于硅酸,
二氧化碳能与硅酸钠反应制得硅酸沉淀,由于CO2中混有二氧化硫,二氧化硫也能与硅酸钠溶液反应,
需要酸性高锰酸钾溶液除去,防止干扰检验二氧化碳;
故答案为:酸性高锰酸钾溶液,Na2SiO3;
(4)若D中高锰酸钾溶液不褪色,说明二氧化硫除尽,E中溶液变浑浊,说明含有二氧化碳气体;空气中含有二氧化碳,可能干扰实验,故应排除空气中二氧化碳的干扰,将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥管可排除空气中二氧化碳的干扰,
故答案为:D中高锰酸钾溶液不褪色,E中溶液变浑浊;将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥.
II、步骤①另取少量待测液于试管C中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色,溴溶解在四氯化碳中,下层为橙红色,说明含Br-;
步骤②另取少量待测液于试管B中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液,观察到白色沉淀的生成,说明含SO42-;
步骤③加新制饱和溴水与亚硫酸根离子的氧化还原反应,观察溴水褪色,说明含SO32-,
故答案为:
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 溶液分层,下层呈橙红色 | |
| 步骤② | 加入过量的2mol/L盐酸,再滴加1mol/L BaCl2溶液 | |
| 步骤③ | 新制饱和溴水 | 溴水褪色 |
点评 本题考查实验室制备氯气的反应原理和装置分析,物质性质的比较,掌握基本操作和物质性质是解题关键,题目难度中等.


已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,
加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液.
步骤2:取一支50mL碱式滴定管,用bmol•L-1的新制Na2S2O3溶液润洗2~3次后,装满溶液,调节液面高度至0刻度.
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图2 | |
| 2 | 0 | 23.98 | 23.98 |
| 3 | 0 | 24.02 | 24.02 |
(2)滴定终点的判断方法溶液颜色恰好由蓝色变为无色且半分钟内不褪色.
(3)经过计算,此碘盐碘元素的含量为$\frac{508000b}{a}$mgmg•kg-1(用含a、b的最简表达式表示).
(4)下列操作可能会导致测量结果偏低的是CD.
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失
(5)请在答题纸的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分)
| A. | 该反应证明O2能氧化PtF6 | |
| B. | 22.4LO2参加反应时,转移1mol电子 | |
| C. | O2PtF6中既有离子键又有共价键 | |
| D. | 68.2g O2PtF6中含有1.204×1024个分子 |
Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置,加热A 中的AgNO3同体,试管A中有红棕色气体产生,B中无红棕色气体产生,在装置C中收集到无色气体.当反应结束后,测得试管中残留黑色同体Ag.(夹持及加热仪器均省略)
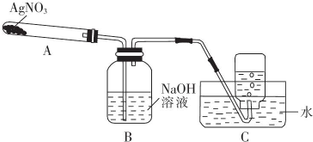
(1)如何检验整套装置的气密性?
(2)C中集气瓶收集的气体为氧气,要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(3)AgNO3分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入盛有AgNO3 溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,
猜测如下:
假设一:Fe被氧化成Fe2+;
假设二:Fe被氧化成Fe3+;
假设三:Fe被氧化成Fe2+ 和Fe3+.
已知:溶液中的Ag+能与SCN-反应,干扰实验.选用如下试剂设计一个实验验证假设三.
可选用的试剂:KSCN溶液、酸性 KMnO4溶液、氯水、盐酸、硝酸、NaCl溶液.
请完成下表:
| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | - | 除尽Ag+ |
| (2)取少量上述溶液于试管中,加入KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上述溶液于试管中,加入酸性KMnO4溶液,振荡 | 血红色消失 | 存在Fe2+ |
| A. | ①②③④ | B. | ④③②① | C. | ③②④① | D. | ③①②④ |
| A. | (b-2a) mol | B. | $\frac{b}{2}$mol | C. | $\frac{2a}{3}$ mol | D. | 2a mol |