题目内容
12.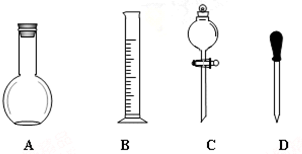 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.(1)在如图所示仪器中,配制上述溶液肯定不需要的是A、C(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是烧杯、玻璃棒、500mL容量瓶.
(2)在容量瓶的使用方法中,下列操作不正确的是B、C、D
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算用托盘天平称取的质量为2.0g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度小于0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为13.6mL,如果实验室有15mL、20mL、50mL量筒,应选用15mL量筒最好.
分析 (1)根据配制一定物质的量浓度的溶液实验需要的仪器进行分析;
(2)根据容量瓶的使用方法和注意事项来回答问题;
(3)根据公式m=nM=cvM来计算;根据定容时眼的视线要和凹液面的最低处相平结合公式c=$\frac{n}{V}$来分析误差;
(4)根据稀释前后溶质的质量不变列方程来计算,根据量筒的量取规则来选择.
解答 解:(1)配制一定物质的量浓度的溶液所必需的仪器有:一定规格的容量瓶,托盘天平、烧杯、玻璃棒、胶头滴管,量筒可用可不用,
故答案为:A、C;烧杯、玻璃棒、500mL容量瓶;
(2)根据容量瓶使用时的注意事项:使用容量瓶前检验是否漏水、容量瓶用水洗净后,不能用待配溶液洗涤、不能盛放热溶液、不能作为稀释仪器等,
故答案为:B、C、D;
(3)容量瓶没有450ml,应选择500ml的来配置,据公式m=nM=cvM=0.1mol/L×0.5L×40g/mol=2.0g,若定容时仰视刻度线,则实际溶液体积超过500mL,故所得浓度偏小,
故答案为:2.0g;小于;
(4)设浓硫酸的体积为VmL,稀释前后溶质的质量不变,则:98%×1.84g/cm3V=0.5mol/L×0.50L×98g/mol,解得V=13.6mL,
为减小误差,应选用15mL的量筒,
故答案为:13.6;15.
点评 本题考查了配制一定物质的量浓度的溶液的方法,熟悉配制过程是解题关键,注意误差分析的方法和技巧,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2. 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.10mol/L NaOH标准溶液.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
①第一次实验滴定前液面在0刻度,滴定后如下丙图所示,则第一次实验滴定完用去NaOH溶液的体积记录为22.50 mL,滴定达到终点的现象是当滴入最后一滴氢氧化钠溶液时,溶液由无色恰好变成浅红色,且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.093mol/L(保留两位有效数字)
③NaOH溶液要使用下面哪个仪器乙(填甲 或乙).
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有D、F.(多选扣分)(选对一个得2分,多选错选不得分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:(1)配制100mL 0.10mol/L NaOH标准溶液.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.50 | 20.00 |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.093mol/L(保留两位有效数字)
③NaOH溶液要使用下面哪个仪器乙(填甲 或乙).
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有D、F.(多选扣分)(选对一个得2分,多选错选不得分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
20.下列有关说法合理的是( )
| A. | 根据分散系是否有丁达尔现象,将分散系分为胶体、浊液和溶液 | |
| B. | 用盐酸可以清洗长期存放过FeCl3溶液的试剂瓶 | |
| C. | 二氧化硅广泛用于制作计算机芯片和光导纤维 | |
| D. | 电解精炼铜时,阳极泥中含有Fe、Ag、Au等金属 |
7.下面叙述中正确的是( )
| A. | 1mol冰中有4NA个氢键 | |
| B. | 12克石墨中C---C键为2NA | |
| C. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有6个 | |
| D. | 六方最密堆积中,每个原子的配位数是12 |
17.合金是一类用途广泛的金属材料,下列关于合金的说法正确的是( )
| A. | 钢是铁的一种合金 | |
| B. | 通常合金的硬度比不上纯净的金属 | |
| C. | 合金是两种金属熔合而成的具有金属特性的物质 | |
| D. | 一般地说合金的熔点比它的各成分金属的熔点都高 |
4.今有如下三个热化学方程式:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=a kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=b kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=c kJ•mol-1
下列关于它们的表述正确的是( )
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=a kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=b kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=c kJ•mol-1
下列关于它们的表述正确的是( )
| A. | 它们都是吸热反应 | B. | a、b和c均为正值 | ||
| C. | 反应热的关系:2b=c | D. | 反应热的关系:a=b |

 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.