题目内容
8.将Fe和Cu的混合物粉末加入FeCl3溶液中.(1)若反应后只有Cu剩余,则溶液中阳离子一定有Fe2+,可能有Cu2+.(水电离出的H+除外)
(2)若反应后有Fe剩余,则溶液中阳离子一定有Fe2+,一定没有Cu2+、Fe3+.
(3)若反应后没有固体剩余,溶液中阳离子一定有Fe2+、Cu2+,可能有Fe3+.
(4)在稀硫酸中加入铜粉,铜粉不溶解,再加入下列固体粉末:①FeCl2; ②Fe2O3; ③Zn; ④KNO3,铜粉可能溶解的是②④,使Cu粉溶解的离子方程式为2Fe3++Cu═2Fe2++Cu2+、3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
分析 将Fe和Cu的混合物粉末加入FeCl3溶液中,还原性Fe>Cu,先发生Fe+2FeCl3=3FeCl2,后发生Cu+2FeCl3═CuCl2+2FeCl2,以此解答(1)~(3);
(4)硝酸盐在酸性溶液中具有强氧化性,可溶解Cu,或氧化性离子与Cu反应,以此来解答.
解答 解:(1)反应后只有Cu剩余,则一定不存在氯化铁,则一定发生Fe+2FeCl3=3FeCl2,可能发生Cu+2FeCl3═CuCl2+2FeCl2,即一定存在的离子为Fe2+,可能有Cu2+,
故答案为:Fe2+;Cu2+;
(2)反应后有Fe剩余,只发生Fe+2FeCl3=3FeCl2,即一定存在的离子为Fe2+,一定没有Cu2+、Fe3+,故答案为:Fe2+;Cu2+、Fe3+;
(3)反应后没有固体剩余,发生Fe+2FeCl3=3FeCl2、Cu+2FeCl3═CuCl2+2FeCl2,溶液中阳离子一定有Fe2+、Cu2+,可能有Fe3+,故答案为:Fe2+、Cu2+;Fe3+;
(4)铜粉可能溶解的是②④,离子反应分别为2Fe3++Cu═2Fe2++Cu2+、3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:②④;2Fe3++Cu═2Fe2++Cu2+、3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
点评 本题考查金属的化学性质及氧化还原反应,为高频考点,把握还原性强弱、反应的先后顺序为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
19.下列物质肯定为纯净物的是( )
| A. | 汽油 | B. | C2H4 | C. | 煤焦油 | D. | 聚氯乙烯 |
16.下列说法不正确的是( )
| A. | 明矾、漂白粉都可以用于净水,但净水原理不相同 | |
| B. | 游离态氮转化为化合态氮,只有在高温、高压和催化剂的作用下才能实现 | |
| C. | 制造光缆和计算机芯片的主要材料都含有硅元素 | |
| D. | 农业上使用高效低毒的农药,可降低蔬菜的农药残留 |
13.化学是一门以实验为基础的学科,请完成下列有关实验问题.
Ⅰ.如图是实验室中制备气体或验证气体性质的装置图
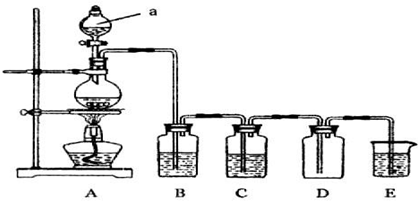
(1)写出用A制取氯气的化学方程式MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O.
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+,则装置B中的溶液的作用是除去氯气中的氯化氢;装置D中加的最佳试剂是(填序号)c:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在如图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
此时,B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的酸性高锰酸钾(填溶液名称),E中加入Na2SiO3溶液(填化学式).
(4)证明碳元素的非金属性比硅元素的强的现象为D中高锰酸钾溶液不褪色,E中溶液变浑浊;
实验2不严谨之处应如何改进将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥管.
Ⅱ、向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色.反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告.
限选试剂:2mol/LHCl,1mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水.
Ⅰ.如图是实验室中制备气体或验证气体性质的装置图

(1)写出用A制取氯气的化学方程式MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O.
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+,则装置B中的溶液的作用是除去氯气中的氯化氢;装置D中加的最佳试剂是(填序号)c:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在如图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
此时,B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的酸性高锰酸钾(填溶液名称),E中加入Na2SiO3溶液(填化学式).
(4)证明碳元素的非金属性比硅元素的强的现象为D中高锰酸钾溶液不褪色,E中溶液变浑浊;
实验2不严谨之处应如何改进将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥管.
Ⅱ、向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色.反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告.
限选试剂:2mol/LHCl,1mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水.
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色. | 溶液分层,下层呈橙红色,证明待测液中含Br-. |
| 步骤② | 在试管B中加入少量待测液,加入过量的2mol/L盐酸,再滴加1mol/L BaCl2溶液 | 有白色沉淀生成, 证明待测液中含SO42-. |
| 步骤③ | 在试管C中加入少量待测液,滴加2mol/LHCl至溶液呈酸性,加入几滴新制饱和溴水(填试剂),振荡. | 溴水褪色, 证明待测液中含SO32-. |
17.制取CH3CH2Cl最好的方法是( )
| A. | 乙烷与氯气反应 | B. | 乙烯与氯气反应 | C. | 乙烷与HCl反应 | D. | 乙烯与HCl反应 |
18.下列有关实验的做法不正确的是( )
| A. | 分液时,分液漏斗的上层液体应由上口到出 | |
| B. | 用重结晶法分离碳酸钠和碳酸氢钠两种固体 | |
| C. | 配置0.1000 mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 |
