题目内容
11.下面几种熟悉的物质:①O2 ②CO2 ③NaBr ④H2SO4 ⑤Na2CO3 ⑥K2S ⑦NaHSO4这些物质中,只含共价键的是①②④;只含离子键的是③⑥;既含共价键又含离子键的是⑤⑦.(填序号)
分析 一般来说活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性共价键,同种非金属元素之间易形成非极性共价键,单原子分子中不含化学键;
解答 解:①O2中O原子之间只存在非极性共价键,为单质;
②CO2中O与C原子之间只存在极性共价键;
③NaBr中钠离子与溴离子之间是离子键;
④H2SO4中原子之间只存在极性共价键;
⑤Na2CO3中钠离子与碳酸根离子之间是离子键,而碳酸根离子中氧原子与碳原子之间只存在极性共价键;
⑥K2S中钾离子与硫离子之间是离子键;
⑦NaHSO4中钠离子与硫酸氢根离子之间是离子键,而硫酸氢根离子中原子间是共价键;
故答案为:只含共价键的是①②④;只含离子键的是③⑥;既含共价键又含离子键的是⑤⑦.
点评 本题考查了物质和化学键的关系,根据物质的构成微粒确定化学键,知道离子键和共价键的区别,注意稀有气体中不存在化学键,为易错点.

练习册系列答案
相关题目
19.已知下列反应:2FeCl2+Cl2═2FeCl3;2FeCl3+2KI═2FeCl2+2KCl+I2,下列判断正确的是( )
| A. | 氧化性Cl2>Fe3+>I2 | B. | 还原性 Fe2+>Cl->I- | ||
| C. | 氧化性Fe3+>Cl2>I2 | D. | 还原性 Fe2+>I->Cl- |
6.将agFe2O3和Al2O3的样品溶解在过量的200mL物质的量浓度为0.05mol/L的H2SO4溶液中,然后向其中加入NaOH溶液使Al3+、Fe3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.4 mol/L | D. | 0.6mol/L |
16.下列溶液中Cl-浓度最大的是( )
| A. | 10 ml 1.0 mol/L AlCl3 溶液 | B. | 100ml 1mol/L KCl 溶液 | ||
| C. | 50 ml 1.5mol/L NH4Cl 溶液 | D. | 100 ml 1.0 mol/L MgCl2 溶液 |
1.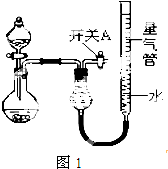 某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
(1)实验过程中,使用分液漏斗滴加液体的操作是打开分液漏斗上口塞子,旋开下面的开关,慢慢滴加;
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”),原因是NO会与装置中空气反应;生成NO2溶于水
(3)实验Ⅱ中量气管中的液体最好是C(填字母编号,下同)
A.浓NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
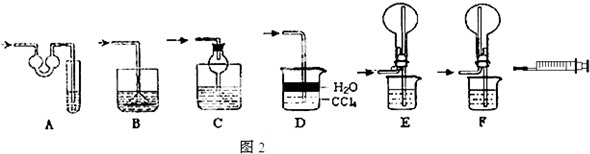
该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,不能防止倒吸的是图2中的BE.
(4)写出实验Ⅲ中涉及的离子反应方程式2Al+2H2O+2OH-=2AlO2-+3H2↑;
(5)实验Ⅲ获得如表数据(气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
根据表中数据,可计算出镁铝合金中铝的质量分数为27%.
 某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”),原因是NO会与装置中空气反应;生成NO2溶于水
(3)实验Ⅱ中量气管中的液体最好是C(填字母编号,下同)
A.浓NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,不能防止倒吸的是图2中的BE.

(4)写出实验Ⅲ中涉及的离子反应方程式2Al+2H2O+2OH-=2AlO2-+3H2↑;
(5)实验Ⅲ获得如表数据(气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.