17. 为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
Ⅰ.AgNO3的热稳定性
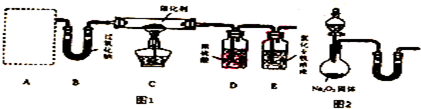
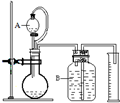
利用如图所示的实验装置,加热A中的AgNO3固体,试管A中有红棕色气体产生,B中无红棕色气体产生,在装置C中收集到无色气体.当反应结束后,测得试管中残留黑色固体Ag.(夹持及加热仪器均省略)
(1)C中集气瓶收集的气体为氧气,要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(2)甲同学认为仅凭试管A中有红棕色的气体产生就判定有NO2产生是错误的,因为无色NO遇到空气也会变成红棕色,所以加热前应当排净装置中的空气,你是否同意他的观点?并说明理由:否;硝酸银分解生成氧气.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入盛有AgNO3溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,猜测如下:
假设一:Fe被氧化成Fe2+;
假设二:Fe被氧化成Fe3+;
假设三:Fe被氧化成Fe2+或Fe3+.
已知:溶液中的Ag+能与SCN-反应,干扰实验.选用如下试剂设计一个实验验证假设三.可选用的试剂:KSCN溶液、酸性KMnO4溶液、氯水、盐酸、硝酸、NaCl溶液.完成如表:
实验结论:Fe的氧化产物为Fe2+和Fe3+.
 为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置,加热A中的AgNO3固体,试管A中有红棕色气体产生,B中无红棕色气体产生,在装置C中收集到无色气体.当反应结束后,测得试管中残留黑色固体Ag.(夹持及加热仪器均省略)
(1)C中集气瓶收集的气体为氧气,要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(2)甲同学认为仅凭试管A中有红棕色的气体产生就判定有NO2产生是错误的,因为无色NO遇到空气也会变成红棕色,所以加热前应当排净装置中的空气,你是否同意他的观点?并说明理由:否;硝酸银分解生成氧气.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入盛有AgNO3溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,猜测如下:
假设一:Fe被氧化成Fe2+;
假设二:Fe被氧化成Fe3+;
假设三:Fe被氧化成Fe2+或Fe3+.
已知:溶液中的Ag+能与SCN-反应,干扰实验.选用如下试剂设计一个实验验证假设三.可选用的试剂:KSCN溶液、酸性KMnO4溶液、氯水、盐酸、硝酸、NaCl溶液.完成如表:
| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | 白色沉淀 | 除尽Ag+ |
| (2)取少量上层清液于试管中,加入取少量上述溶液于试管中加入 KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上层清液于试管中,加入加入 酸性KMnO4溶液,振荡 | 紫红色消失 | 存在Fe2+ |
11.某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.
(1)【提出假设】假设1:Fe2+还原性比I-强;假设2:I-还原性比Fe2+强;假设3:Fe2+和I-的还原性一样强.
【验证假设】
(2)利用以下装置进行试验
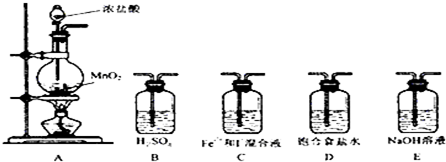
实验必需的装置是:A→C→E(按氯气流向的顺序用序号书写)
(3)实验开始后,控制通入少量氯气,通过观察溶液颜色的变化,不能(能或不能)判断反应的先后顺序.
(4)请在表中填写实验步骤及预期现象与结论.
(5)该实验成功的关键是控制各反应物的用量.该小组称量1.52gFeSO4(M=152g/mol)和1.66gKI(M=166g/mol)固体溶于水中,为了验证上述假设,通入的氯气的体积最多不能超过0.112L.(标准状况)
(6)有同学质疑,上述实验只能验证氯气分别与Fe2+和I-反应的速率的大小.并不能证明Fe2+和I-的还原性强弱.于是提出另一验证方案:往KI溶液中滴加FeCl3溶液,如果能发生反应,就可证明二者的还原性强弱,该反应的离子方程式是2I-+2Fe3+=I2+2Fe2+.
0 170707 170715 170721 170725 170731 170733 170737 170743 170745 170751 170757 170761 170763 170767 170773 170775 170781 170785 170787 170791 170793 170797 170799 170801 170802 170803 170805 170806 170807 170809 170811 170815 170817 170821 170823 170827 170833 170835 170841 170845 170847 170851 170857 170863 170865 170871 170875 170877 170883 170887 170893 170901 203614
(1)【提出假设】假设1:Fe2+还原性比I-强;假设2:I-还原性比Fe2+强;假设3:Fe2+和I-的还原性一样强.
【验证假设】
(2)利用以下装置进行试验

实验必需的装置是:A→C→E(按氯气流向的顺序用序号书写)
(3)实验开始后,控制通入少量氯气,通过观察溶液颜色的变化,不能(能或不能)判断反应的先后顺序.
(4)请在表中填写实验步骤及预期现象与结论.
| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加KSCN; 向B试管中滴加淀粉: | ①若A变红色, B不变色则假设1成立 ②若A不变色, B变蓝色则假设2成立 ③若A变红色, B变蓝色则假设3成立 |
(6)有同学质疑,上述实验只能验证氯气分别与Fe2+和I-反应的速率的大小.并不能证明Fe2+和I-的还原性强弱.于是提出另一验证方案:往KI溶液中滴加FeCl3溶液,如果能发生反应,就可证明二者的还原性强弱,该反应的离子方程式是2I-+2Fe3+=I2+2Fe2+.
 +H2O.
+H2O.
 工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质.为测定碱中各成分的百分含量可采用滴定法、气体法等.
工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质.为测定碱中各成分的百分含量可采用滴定法、气体法等.
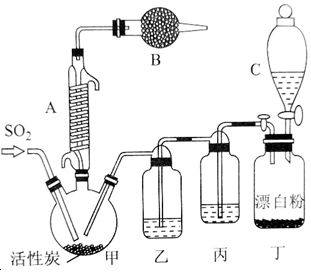 SO2(g)+Cl2(g)$\stackrel{活性炭}{?}$SO2Cl2(1)△H=-97.3kJ•mol-1 请回答下列问题:
SO2(g)+Cl2(g)$\stackrel{活性炭}{?}$SO2Cl2(1)△H=-97.3kJ•mol-1 请回答下列问题: