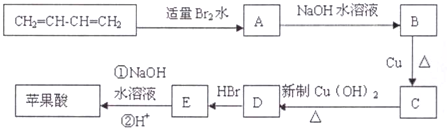
题目内容
13.硫酰氯(SO2Cl2)常用做氯化剂或氯磺化剂,如芳香族化合物的氯化、羧酸的氯化及其他各种有机和无机化合物的氯化,也用于制造药品、燃料、表面活性剂等.硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”,100℃以上便开始分解为二氧化硫和氯气,工业上常采用氧化法合成硫酰氯,将干燥的二氧化硫和氯气在一定条件下进行反应,其反应原理和实验装置如下: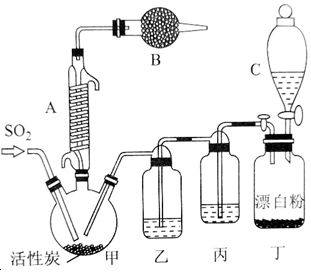 SO2(g)+Cl2(g)$\stackrel{活性炭}{?}$SO2Cl2(1)△H=-97.3kJ•mol-1 请回答下列问题:
SO2(g)+Cl2(g)$\stackrel{活性炭}{?}$SO2Cl2(1)△H=-97.3kJ•mol-1 请回答下列问题:(1)仪器A的名称是球形冷凝管
(2)干燥管B中盛放的药品是碱石灰,作用是吸收未反应的二氧化硫与氯气以及空气中的水蒸气
(3)实验时从仪器C中放出液体的操作方法是打开分液漏斗上口玻璃塞,再旋转活塞使液体流下
(4)装置乙中盛放的物质为浓硫酸,若缺少装置乙,对实验结果有什么影响?氯气和二氧化硫、水反应生成HCl与硫酸,降低了硫酰氯的产量
(5)氯磺酸(ClSO3H)是一种无色的发烟液体,有刺激性臭味,沸点178℃,受热分解也能制得硫酰氯,同时还有另外一种物质生成,该反应的化学方程式为2C1SO3H$\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4,分离产物的方法是蒸馏
A.重结晶 B.过滤 C.蒸馏 D.萃取
(6)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有AC(填序号)
A.控制气流速度,宜慢不宜快 B.水浴加热三劲烧瓶 C.若三劲烧瓶发烫,可适当降温.
分析 (1)由仪器A的结构特征,可知A为冷凝管;
(2)由于SO2Cl2在潮湿空气中“发烟”,装置B的作用是吸收空气中水蒸气,且吸收未反应的二氧化硫与氯气,防止污染空气;
(3)打开分液漏斗上口玻璃塞,平衡气压,再旋转活塞使液体流下;
(4)丁装置制备的氯气中含有HCl、水蒸气,丙装置盛放饱和食盐水,除去混有的HCl,乙装置盛放浓硫酸,干燥氯气,若缺少装置乙,氯气和二氧化硫、水反应生成HCl与硫酸;
(5)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯(SO2Cl2)与另外一种物质,由元素守恒可知,另外物质含有H元素,C1SO3H中S、Cl原子数目之比为1:1,而SO2Cl2中S、Cl原子数目之比为1:2,故另外物质中含有S元素,结合原子守恒可知另外物质为H2SO4;二者为互溶液体,沸点相差较大,采取蒸馏法进行分离;
(6)提高本实验中硫酰氯的产率,可以控制气体流速,使其充分反应,该反应为放热反应,可以对三颈烧瓶进行适当的降温.
解答 解:(1)由仪器A的结构特征,可知A为球形冷凝管,故答案为:球形冷凝管;
(2)由于SO2Cl2在潮湿空气中“发烟”,装置B的作用是吸收空气中水蒸气,且吸收未反应的二氧化硫与氯气,防止污染空气,可以盛放碱石灰,故答案为:碱石灰;吸收未反应的二氧化硫与氯气以及空气中的水蒸气;
(3)从仪器C中放出溶液的操作方法是:打开分液漏斗上口玻璃塞,再旋转活塞使液体流下,故答案为:打开分液漏斗上口玻璃塞,再旋转活塞使液体流下;
(4)丁装置制备的氯气中含有HCl、水蒸气,丙装置盛放饱和食盐水,除去混有的HCl,乙装置盛放浓硫酸,干燥氯气,若缺少装置乙,氯气和二氧化硫、水反应生成HCl与硫酸,反应方程式为:Cl2+SO2+2H2O=2HCl+H2SO4;从而降低了硫酰氯的产量,故答案为:浓硫酸;氯气和二氧化硫、水反应生成HCl与硫酸,降低了硫酰氯的产量;
(5)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯(SO2Cl2)与另外一种物质,由元素守恒可知,另外物质含有H元素,C1SO3H中S、Cl原子数目之比为1:1,而SO2Cl2中S、Cl原子数目之比为1:2,故另外物质中含有S元素,结合原子守恒可知另外物质为H2SO4,反应方程式为:2C1SO3H$\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4,二者为互溶液体,沸点相差较大,采取蒸馏法进行分离,故答案为:2C1SO3H$\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4;蒸馏;
(6)为提高本实验中硫酰氯的产率,可以控制气体流速,宜慢不宜快,使其充分反应,由于100℃以上SO2Cl2开始分解,该反应为放热反应,可以对三颈烧瓶进行适当的降温,故答案为:AC.
点评 本题考查实验制备方案,涉及对反应原理、装置及操作的分析评价、对仪器的识别、物质的分离提纯等,注意对物质性质信息的应用,难度中等.

 考前必练系列答案
考前必练系列答案①增大氢气的浓度
②升高温度
③降低温度
④缩小体积
⑤增大HI的浓度
⑥减小压强.
| A. | ①③⑥ | B. | ②④⑤ | C. | ③⑤⑥ | D. | ①③⑤ |
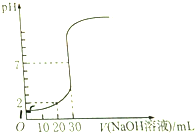 用NaOH溶液滴定10mL盐酸,滴定过程中溶液的pH变化如图.NaOH溶液和盐酸的物质的量浓度(单位:mol•L-1)分别为( )
用NaOH溶液滴定10mL盐酸,滴定过程中溶液的pH变化如图.NaOH溶液和盐酸的物质的量浓度(单位:mol•L-1)分别为( )| A. | 0.12,0.04 | B. | 0.04,0.12 | C. | 0.12,0.06 | D. | 0.03,0.09 |

有关物质的性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
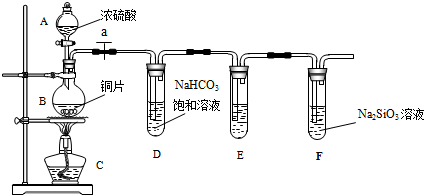
组装仪器、检验装置气密性、加装药品,通N2一段时间后点燃酒精灯.反应结束后的操作包括:
①停止通N2②熄灭酒精灯③冷却至室温.正确的顺序为②③①(填序号).欲分离D中的液态混合物,所采用操作的名称是蒸馏.
| A. | v(A)=0.3mol/(L•s) | B. | v(B)=0.3mol/(L•s) | C. | v(C)=0.3mol/(L•s) | D. | v(D)=1mol/(L•s) |
| A. | 9.0g C2H6 | B. | 标准状况下5.6L 空气 | ||
| C. | 0.75mol N2 | D. | 3.01×1023 个臭氧分子 |
| A. | 16 g•mol-1 | B. | 16 0g•mol-1 | C. | 64 g•mol-1 | D. | 8 g•mol-1 |
 +H2O.
+H2O.