题目内容
12.甲、乙两化学活动小组对中学化学教材中氨的催化进行了实验探究.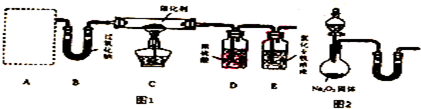
(1)甲小组设计了如图1所示的实验装置(固定装置已略去).
①若A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和b(填序号).
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是与水和二氧化碳反应,产生C中所需的反应物氧气.
③装置C中发生反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
④若A、B中药品足量,则要以观察到E中溶液发生变化,其现象是溶液变为黄色.
⑤某同学从安全与环保的角度考虑,指出该装置有两处明显的缺陷,你认为这两处缺陷应该是:D中液体可能会倒吸;尾气会污染环境.
⑥若A中固体质量减少了7.9g,则通过B(过氧化钠足量)后,气体的体积变为4.48L(标准状况).
(2)如图2,乙小组认为可将甲小组的装置中A、B部分换成如图所示装置(其余部分相同)进行实验,烧瓶中加入的是过氧钠固体,则分液漏斗中加入的最佳试剂是浓氨水;U形管中加入的试剂是碱石灰(或氢氧化钠、氧化钙).
分析 (1)①根据碳酸氢铵,受热分解生成NH3、CO2和H2O选择仪器;
②根据碳酸氢铵受热分解的产物以及过氧化钠的性质分析解答;
③NH3与O2在催化剂、加热条件下发生反应生成一氧化氮和水;
④若A、B中药品足量,则进入氯化亚铁溶液的气体为一氧化氮、氧气的混合气体,通入溶液中生成硝酸,硝酸能氧化亚铁离子;
⑤根据需在装置C、D之间增加一个防倒吸装置,氮的氧化物有毒,分析实验装置的优劣;
⑥根据参加反应的碳酸氢铵的质量求出分解产生的氨气、二氧化碳、水蒸气的物质的量,根据它们与过氧化钠的反应求解最终生成气体的体积;
(2)根据甲小组的装置中A、B部分用途分析替代装置,氨气是碱性气体,极易溶于水,做氨气干燥剂的物质不能和氨气反应,所以干燥氨气的物质应为碱性或中性.
解答 解:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,进行氨的催化氧化实验,需氨气和氧气,氨气用碳酸氢铵制备,氧气用二氧化碳与过氧化钠反应制备,氨气和氧气催化氧化需用铂粉作催化剂,一氧化氮二氧化氮都是空气污染物,所以需进行尾气吸收.
(1)①若A中使用的药品是NH4HCO3固体,加热NH4HCO3固体需要酒精灯,故答案为:b;
②装置B中盛放过氧化钠,碳酸氢铵,受热分解生成NH3、CO2和H2O,过氧化钠和水反应2Na2O2+2H2O=4NaOH+O2↑,该反应能提供氧气,二氧化碳与过氧化钠,2Na2O2+2CO2═2Na2CO3+O2,该反应也能提供氧气,所以装置B的作用是与水和二氧化碳反应,产生C中所需的反应物氧气,
故答案为:与水和二氧化碳反应,产生C中所需的反应物氧气;
③NH3与过量O2在催化剂、加热条件下发生反应生成一氧化氮和水,反应方程为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
④若A、B中药品足量,则进入氯化亚铁溶液的气体为一氧化氮、氧气的混合气体,4NO+3O2+2H2O=4HNO3,硝酸能将亚铁离子氧化成铁离子,所以溶液变为黄色,
故答案为:溶液变为黄色;
⑤为防止倒吸可以在装置C、D之间增加一个防倒吸装置,一氧化氮以及生成的二氧化氮均有毒,应加一个尾气吸收装置,
故答案为:D中液体可能会倒吸;尾气会污染环境;
⑥若A中固体质量减少了7.9g,则参加反应的NH4HCO3固体为$\frac{7.9g}{79g/mol}$=0.1mol,NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑,生成氨气、二氧化碳、水各0.1mol,氨气与过氧化钠不反应,二氧化碳、水与过氧化钠反应各0.1mol,各生成0.5mol氧气,所以气体的物质的量为0.1mol+0.05mol+0.05mol=0.2mol,V=nVm=0.2mol×22.4mol/L=4.48L,
故答案为:4.48;
(2)A装置提供二氧化碳、水蒸气、氨气,装置B为干燥氨气,所以当有过氧化钠存在时需用浓氨水,省略了将二氧化碳、水蒸气转化成氧气,氨气为碱性气体,干燥氨气的物质应为碱性或中性需选用碱石灰(或氢氧化钠、氧化钙);
故答案为:浓氨水;碱石灰(或氢氧化钠、氧化钙).
点评 本题主要考查了氨气的催化氧化,解答须根据题目中提供的药品和装置结合该反应的原理和相关物质的性质,题目难度中等.

| 选项 | H2SO4 | Na2S2O3 | H2O |
| A | 5mL0.1mol/L | 5mL0.1mol/L | 0 |
| B | 5mL0.2mol/L | 5mL0.1mol/L | 10 |
| C | 5mL0.3mol/L | 5mL0.1mol/L | 20 |
| D | 5mL0.4mol/L | 5mL0.1mol/L | 30 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 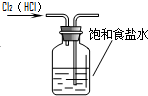 除去Cl2中的HCl | B. | 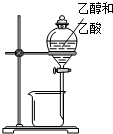 分离乙醇和乙酸 | C. | 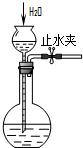 检查装置气密性 | D. | 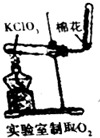 实验室制取O2 |
 为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置,加热A中的AgNO3固体,试管A中有红棕色气体产生,B中无红棕色气体产生,在装置C中收集到无色气体.当反应结束后,测得试管中残留黑色固体Ag.(夹持及加热仪器均省略)
(1)C中集气瓶收集的气体为氧气,要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(2)甲同学认为仅凭试管A中有红棕色的气体产生就判定有NO2产生是错误的,因为无色NO遇到空气也会变成红棕色,所以加热前应当排净装置中的空气,你是否同意他的观点?并说明理由:否;硝酸银分解生成氧气.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入盛有AgNO3溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,猜测如下:
假设一:Fe被氧化成Fe2+;
假设二:Fe被氧化成Fe3+;
假设三:Fe被氧化成Fe2+或Fe3+.
已知:溶液中的Ag+能与SCN-反应,干扰实验.选用如下试剂设计一个实验验证假设三.可选用的试剂:KSCN溶液、酸性KMnO4溶液、氯水、盐酸、硝酸、NaCl溶液.完成如表:
| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | 白色沉淀 | 除尽Ag+ |
| (2)取少量上层清液于试管中,加入取少量上述溶液于试管中加入 KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上层清液于试管中,加入加入 酸性KMnO4溶液,振荡 | 紫红色消失 | 存在Fe2+ |
 碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体.
【进行实验】为了验证碳酸氢钠受热时的分解产物,兴趣小组的同学取一定质量的碳酸氢钠放到铜片上充分加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有无色小液滴,证明生成了水.
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察有关现象,说明生成了二氧化碳.
(3)兴趣小组的同学认为:充分加热后的固体产物可能是NaOH或Na2CO3.
①他们的依据是质量守恒定律(或化学反应前后元素种类不变、化学反应前后原子种类不变、NaHCO3中含有Na、H、C、O元素等,合理答案均可).
②兴趣小组为确定反应后的固体产物成分进行了以下实验,请填写下表:
| 实 验 | 实验现象 | 结 论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞溶液 | 溶液变成红色 | 固体产物是NaOH,而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入过量氯化钙溶液 | 产生白色沉淀 | 固体产物是Na2CO3,而不是NaOH |
| 实验三:取少量反应后的固体产物溶于水,加入足量稀盐酸 | 产生大量气泡 | 固体产物是Na2CO3 |
【拓展应用】碳酸氢钠常用来治疗胃酸过多,但对于患胃溃疡的病人胃酸(用盐酸表示)过多时,却不宜服用碳酸氢钠,用化学方程式表示其原因是HCl+NaHCO3=NaCl+CO2↑+H2O.
| A. | H2SO4的摩尔质量是98g | |
| B. | 标准状况下,2.24 L水的质量是1.8g | |
| C. | 16gO3比16gO2所含的氧原子数多 | |
| D. | 22g二氧化碳与标准状况下11.2L HCl含有相同的分子数 |
 (1)NO2-的定性检验:在酸性介质中,NO2-和Fe2+反应产生棕色的[Fe(NO)]2+(N为+2价),反应的离子方程式为2Fe2++NO2-+2H+═Fe3++[Fe(NO)]2++H2O.
(1)NO2-的定性检验:在酸性介质中,NO2-和Fe2+反应产生棕色的[Fe(NO)]2+(N为+2价),反应的离子方程式为2Fe2++NO2-+2H+═Fe3++[Fe(NO)]2++H2O.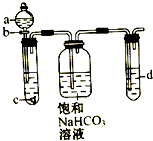 某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.
某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.
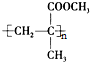 .
.