题目内容
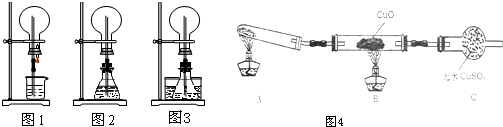
16.已知氨可以与灼热的氧化铜反应得到金属铜,用如图的装置可以实现该反应: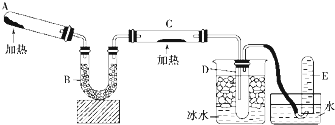
请回答下列问题:
(1)如果A中加入的物质是纯净物,则其可能为碳酸氢铵或碳酸铵,发生反应的化学方程式是NH4HCO3═NH3↑+CO2↑+H2O或(NH4)2CO3═2NH3↑+CO2↑+H2O.
(2)B中加入的物质是碱石灰或生石灰,其作用是除去二氧化碳和水蒸气.
(3)实验时在C中观察到的现象是黑色粉末逐渐变红.
(4)实验时在D中观察到的现象是出现无色液体.
(5)E中收集到的气体经测定在标况下的密度为1.25g/L,则该气体是N2,C中反应的化学方程式为2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O.
分析 根据氨气与灼热的氧化铜反应得到氮气和金属铜,所以A处是产生氨气的反应,用碳酸铵或者碳酸氢铵受热分解得到氨气,氨气中混有水蒸气和二氧化碳气体,用碱石灰除去二氧化碳和水蒸气,氨气易液化,所以氨气和氮气通过冰水冷凝得液氨和氮气,所以E出来的气体是氮气,由此分析解答.
解答 解:根据氨气与灼热的氧化铜反应得到氮气和金属铜,所以A处是产生氨气的反应,用碳酸铵或者碳酸氢铵受热分解得到氨气,氨气中混有水蒸气和二氧化碳气体,用碱石灰除去二氧化碳和水蒸气,氨气易液化,所以氨气和氮气通过冰水冷凝得液氨和氮气,所以E出来的气体是氮气,
(1)A可能是纯净的碳酸氢铵或碳酸铵分解得到氨气,反应方程式为:NH4HCO3═NH3↑+CO2↑+H2O或(NH4)2CO3═2NH3↑+CO2↑+H2O,故答案为:碳酸氢铵或碳酸铵;NH4HCO3═NH3↑+CO2↑+H2O或(NH4)2CO3═2NH3↑+CO2↑+H2O;
(2)B是用碱石灰吸收二氧化碳气体和干燥水,故答案为:碱石灰或生石灰;除去二氧化碳和水蒸气;
(3)C中发生反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,所以观察到黑色粉末逐渐变红,故答案为:黑色粉末逐渐变红;
(4)氨气易液化,所以试管底部出现无色液体,故答案为:出现无色液体;
(5)C装置出来的是氨气和氮气的混合气体,经冷却氨气变成液氨,所以E中收集到的气体是N2;C中反应的化学方程式为2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,
故答案为:N2;2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O.
点评 本题考查学生氨气的实验室制法、干燥以及氨气的还原性方面的知识,结合实验来考查,增加了难度.

 优加精卷系列答案
优加精卷系列答案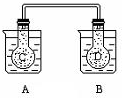 如图所示,在常况下容器A中盛有500mL蒸馏水,在容器B中盛有 500ml 1mol/L的盐酸,在烧瓶C和D中充满二氧化氮气体,并用导管将它们连通.向A容器中加入50g硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入10g苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶C和D中气体的颜色变化是( )
如图所示,在常况下容器A中盛有500mL蒸馏水,在容器B中盛有 500ml 1mol/L的盐酸,在烧瓶C和D中充满二氧化氮气体,并用导管将它们连通.向A容器中加入50g硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入10g苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶C和D中气体的颜色变化是( )| A. | 不变 | B. | 烧瓶C中颜色变深,D中变浅 | ||
| C. | 烧瓶D中变深,C中变浅 | D. | 两个烧瓶中的颜色都变深 |
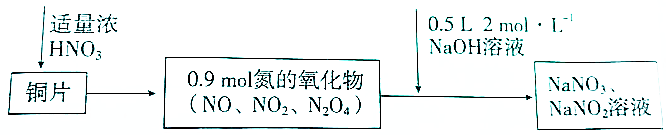
| A. | 若铜片为51.2g.则生成0.2molNaNO3 | |
| B. | 常温下,Cu遇浓硝酸发生钝化.不可能发生上述反应 | |
| C. | 标准状况下收集的氮氧化物为20.16L | |
| D. | 反应过程中生成的Cu(N03)2既是氧化产物,也是还原产物 |
Ⅰ.实验目的:探究同一主族元素性质的递变规律.
Ⅱ.实验用品:碘化钠溶液、溴化钾溶液、溴水、氯水、四氯化碳.
仪器:(1)试管;(2)胶头滴管.(请填写两件主要的玻璃仪器)
Ⅲ.实验内容:
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有适量KBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有适量NaI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
Ⅴ.问题和讨论:
①请用结构理论简单说明得出上述结论的原因:(4)原子半径越大得电子能力越弱
②由于F2如同Na过于活泼,很难设计一个简单的置换反应实验验证其氧化性强弱.试列举一项事实说明F的非金属性比Cl强:(5)分别于氢气反应,F2更容易.
(1)【提出假设】假设1:Fe2+还原性比I-强;假设2:I-还原性比Fe2+强;假设3:Fe2+和I-的还原性一样强.
【验证假设】
(2)利用以下装置进行试验
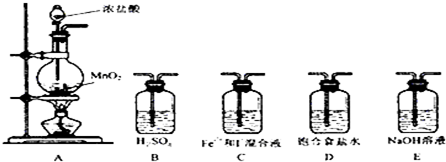
实验必需的装置是:A→C→E(按氯气流向的顺序用序号书写)
(3)实验开始后,控制通入少量氯气,通过观察溶液颜色的变化,不能(能或不能)判断反应的先后顺序.
(4)请在表中填写实验步骤及预期现象与结论.
| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加KSCN; 向B试管中滴加淀粉: | ①若A变红色, B不变色则假设1成立 ②若A不变色, B变蓝色则假设2成立 ③若A变红色, B变蓝色则假设3成立 |
(6)有同学质疑,上述实验只能验证氯气分别与Fe2+和I-反应的速率的大小.并不能证明Fe2+和I-的还原性强弱.于是提出另一验证方案:往KI溶液中滴加FeCl3溶液,如果能发生反应,就可证明二者的还原性强弱,该反应的离子方程式是2I-+2Fe3+=I2+2Fe2+.
| A. | 新制的氯水呈黄绿色,久置的氯水无色 | |
| B. | 新制的氯水漂白作用强,而久置的氯水漂白作用很弱 | |
| C. | 新制的氯水所含成分的种类多,而久置的氯水所含成分的种类较少 | |
| D. | 新制的氯水中无氯离子,而久置的氯水中则含氯离子 |
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: