15.下列有关Na2CO3和NaHCO3性质比较中,正确的是( )
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 常温时水溶液中的溶解度:Na2CO3>NaHCO3 | |
| C. | 与稀盐酸反应快慢:Na2CO3<NaHCO3 | |
| D. | 物质的量相同时,消耗盐酸:Na2CO3<NaHCO3 |
14.下列离子方程式书写正确的是( )
| A. | 硝酸银溶液中加入铜粉:Ag++Cu═Cu2++Ag | |
| B. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 向澄清石灰水中通入足量二氧化碳:OH-+CO2═HCO3- | |
| D. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++2H2O+CO2↑ |
13.下列属于电解质并能导电的物质是( )
| A. | 液态HCl | B. | 熔融的NaOH | C. | KNO3溶液 | D. | FeCl3晶体 |
12.草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl).某学生按下列操作提取草木灰中的钾盐:①取草木灰加水溶解;②过滤、取滤液;③蒸发滤液;④冷却结晶.
(1)为检验草木灰中的离子,取少量晶体溶于水,并把溶液分成四份,完成以下实验报告(在横线上填写相关的内容):
(2)步骤Ⅲ所得的结论,你认为是否正确?否(填“是”或“否”);为什么?引入氯离子,应将氯化钡改为硝酸钡
(3)写出步骤Ⅱ有关现象的化学方程式K2SO4+BaCl2=BaSO4↓+2KCl.
(1)为检验草木灰中的离子,取少量晶体溶于水,并把溶液分成四份,完成以下实验报告(在横线上填写相关的内容):
| 实验步骤 | 实验现象 | 实验结论 |
Ⅰ.取第一份溶液和适量稀盐酸加入下列装置的试管中,把澄清的石灰水加入烧杯中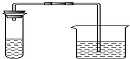 | 气泡产生,澄 清的石灰水变浑浊 | 证明含有碳酸根离子 |
| Ⅱ.取第二份溶液,分别滴加稀盐酸和氯化钡 | 白色沉淀 | 证明含有硫酸根离子 |
| Ⅲ.取第三份溶液加入过量BaCl2溶液,过滤,除去SO42-和CO32-,再滴加AgNO3溶液和稀硝酸 | 有白色沉淀生成生成 | 证明含有氯离子 |
| Ⅳ.取第四份溶液进行焰色反应 | 透过蓝色钴玻璃 火焰呈紫色 | 证明含有K+ |
(3)写出步骤Ⅱ有关现象的化学方程式K2SO4+BaCl2=BaSO4↓+2KCl.
11.下列说法错误的是( )
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都能发生氧化反应 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应是不可逆反应 |
10.下列说法正确的是( )
| A. | 石油的成分只有烷烃 | B. | 石油裂化的过程是物理变化 | ||
| C. | 石油分馏的产品汽油是纯净物 | D. | 石油分馏过程是物理变化 |
9.25℃时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是( )
| A. | 中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积 | |
| B. | 往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全 | |
| C. | 将上述醋酸溶液、氢氧化钠溶液混合得到pH=7的溶液,该溶液中c(Na+)大于c(CH3COO-) | |
| D. | 25℃时pH=3的盐酸、pH=3的醋酸溶液中水电离出的c(H+)均为10-11 mol•L-1 |
6.煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度有关.
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母,下同)
a.容器中的压强不变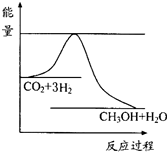
b.1mol H-H键断裂的同时断裂2mol H-O键
c.υ正(CO)=υ逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数
①实验1中以υ(CO2)表示的反应速率为0.16mol•(L•min)-1.
②该反应的逆反应为吸(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2.
0 170694 170702 170708 170712 170718 170720 170724 170730 170732 170738 170744 170748 170750 170754 170760 170762 170768 170772 170774 170778 170780 170784 170786 170788 170789 170790 170792 170793 170794 170796 170798 170802 170804 170808 170810 170814 170820 170822 170828 170832 170834 170838 170844 170850 170852 170858 170862 170864 170870 170874 170880 170888 203614
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度有关.
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母,下同)
a.容器中的压强不变

b.1mol H-H键断裂的同时断裂2mol H-O键
c.υ正(CO)=υ逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应的逆反应为吸(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2.