题目内容
8.过氧化钠与水反应可以制取氧气,现欲制取标准状况下1.12L的氧气,则至少需要过氧化钠的质量为7.8g,产生NaOH的物质的量为0.2mol.分析 根据化学方程式 2Na2O2 +2H2O=4NaOH+O2↑
156 g 4 mol 22.4 L
m(Na2O2) n(NaOH) 1.12 L
可以根据氧气的体积求出参加反应的过氧化钠的质量进行解答.
解答 解:2Na2O2 +2H2O=4NaOH+O2↑
156 g 4 mol 22.4 L
m(Na2O2) n(NaOH) 1.12 L
m(Na2O2)=$\frac{1.12L}{22.4L}$×156 g=7.8 g;
n(NaOH)=$\frac{1.12L}{22.4L}$×4 mol=0.2 mol,
故答案为:7.8g;0.2mol.
点评 本题考查了化学方程式的计算应用,掌握方法和物质性质是关键,题目较简单.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
18.下列各组物质间,不能发生反应的是( )
| A. | 高温下,二氧化硅与氧化钙 | B. | 常温下,硅与氢氟酸溶液 | ||
| C. | 高温下,二氧化硅与碳酸钠固体 | D. | 常温下,二氧化硅与浓硝酸 |
19.下列情况会对人体健康造成较大危害的是( )
| A. | 自来水中通入少量Cl2进行消毒杀菌 | |
| B. | 用小苏打(NaHCO3)发酵面团制作馒头 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| D. | 用SO2漂白食品 |
16.下列化学用语表示正确的是( )
| A. | CS2的比例模型: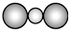 | |
| B. | H2O2的电子式: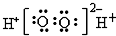 | |
| C. | 氯离子(Cl-)的结构示意图: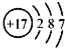 | |
| D. | 基态镁原子的电子排布图:1s22s22p63s2 |
13.下列属于电解质并能导电的物质是( )
| A. | 液态HCl | B. | 熔融的NaOH | C. | KNO3溶液 | D. | FeCl3晶体 |
17.下列事实不能用勒夏特列原理解释的是( )
| A. | 适当加热新制的氯水时,溶液的pH逐渐减小 | |
| B. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | 增大压强,有利于SO2与O2反应生成SO3 |
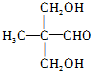 (填结构简式)
(填结构简式)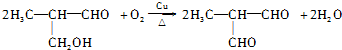
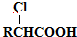 ,以物质C为原料制备聚乳酸(
,以物质C为原料制备聚乳酸(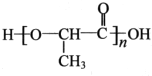 ),可通过四步反应制得,按反应顺序,这四步的反应类型依次是:氧化反应、取代反应、水解反应、缩聚反应.
),可通过四步反应制得,按反应顺序,这四步的反应类型依次是:氧化反应、取代反应、水解反应、缩聚反应. .
.