6.将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
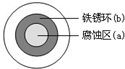

| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-→4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-→Cu2+ |
3. 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )| A. | CO合成甲醇的反应为吸热反应 | |
| B. | 处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$ 增大 | |
| C. | 平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})}$ | |
| D. | 该反应在T1时的平衡常数比T2时的小 |
2.与纯水的电离相似,液氨中也存在着微弱的电离:2NH3?NH4++NH2-,据此判断以下叙述中不正确的是( )
0 170174 170182 170188 170192 170198 170200 170204 170210 170212 170218 170224 170228 170230 170234 170240 170242 170248 170252 170254 170258 170260 170264 170266 170268 170269 170270 170272 170273 170274 170276 170278 170282 170284 170288 170290 170294 170300 170302 170308 170312 170314 170318 170324 170330 170332 170338 170342 170344 170350 170354 170360 170368 203614
| A. | 液氨中含有NH3、NH4+、NH2-微粒 | |
| B. | 其他条件不变,若增加液氨的量,电离平衡将正向移动 | |
| C. | 只要不加入其他物质,液氨中c(NH4+)=c(NH2-) | |
| D. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 |
