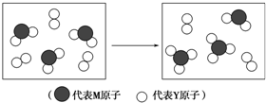
题目内容
3. 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )| A. | CO合成甲醇的反应为吸热反应 | |
| B. | 处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$ 增大 | |
| C. | 平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})}$ | |
| D. | 该反应在T1时的平衡常数比T2时的小 |
分析 A.由图可知,T2温度下到达平衡所以时间较短,反应速率较快,故温度T2>T1.温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应方向移动,据此判断;
B.由图可知,处于A点的反应体系从T1变到T2,温度增大,平衡向逆反应方向移动,据此分析;
C.化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
D.由图可知,T2温度下到达平衡所以时间较短,反应速率较快,故温度T2>T1.温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应方向移动,据此判断.
解答 解:A.由图可知,T2温度下到达平衡所以时间较短,反应速率较快,故温度T2>T1.温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应方向移动,所以合成甲醇的反应为放热反应,故A错误;
B.由图可知,处于A点的反应体系从T1变到T2,温度增大,平衡向逆反应方向移动,氢气物质的量增大,甲醇的物质的量减小,$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$ 增大,故B正确;
C.CO(g)+2H2(g)?CH3OH(g)的平衡常数表达式k=$\frac{c(CH{\;}_{3}OH)}{c(CO)×c{\;}^{2}(H{\;}_{2})}$,故C错误;
D.由图可知,T2温度下到达平衡所以时间较短,反应速率较快,故温度T2>T1.温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应方向移动,化学平衡常数降低,在T1时的平衡常数比T2时的大,故D错误;
故选B.
点评 本题考查化学平衡图象、化学平衡影响因素、化学平衡常数等,难度中等,注意理解外界条件对化学平衡的影响,C选项为易错点,学生容易忽略平均速率与即时速率的区别.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案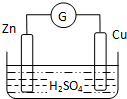
| A. | 外电路中电流由铜极流向锌极 | B. | 正极为电子流入的一极 | ||
| C. | 金属铜为负极 | D. | 发生还原反应的为正极 |
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在酸性溶液中:Ba2+、Na+、SO42-、Cl- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 含大量Fe2+溶液中:K+、Cl-、NO3-、Na+ |
| A. | 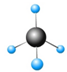 | B. | 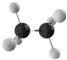 | C. |  | D. |  |
| A. | 氨气极易溶于水 | B. | 氨的催化氧化可生成NO | ||
| C. | 氨气可用浓硫酸干燥 | D. | 氨气为无色有刺激性气味的气体 |
| A. | 氯水 | B. | Na2SiO3溶液 | C. | 浓HNO3 | D. | FeSO4 |
 某学习小组针对化学能转变为其他形式的能量,进行如下实验:
某学习小组针对化学能转变为其他形式的能量,进行如下实验: .
.