题目内容
11.取20mL硫酸和盐酸的混合液体,加入过量的氯化钡溶液,产生4.66g白色沉淀,然后继续向溶液中加入ag(足量)铁粉,产生的气体的体积为896mL(标准状况下).(1)写出上述过程中发生的离子方程式Ba2++SO42-=BaSO4↓、Fe+2H+=Fe2++H2↑.
(2)计算原混合液体中,硫酸物质的量浓度是1mol/L,盐酸物质的量浓度是2mol/L(写出计算过程).
分析 (1)该过程中涉及两个离子反应:钡离子与硫酸根离子反应生成硫酸钡沉淀、铁与氢离子反应生成亚铁离子和氢气,据此写出反应的离子方程式;
(2)生成的白色沉淀为硫酸钡,硫酸的物质的量与硫酸钡的物质的量相等,据此计算出硫酸的物质的量,再根据c=$\frac{n}{V}$计算出硫酸的浓度;铁粉与氢离子反应生成氢气,根据氢气的物质的量及氢元素守恒可计算出原溶液中氢离子浓度,再根据硫酸的浓度计算出盐酸的浓度.
解答 解:(1)该过程中发生的反应有:钡离子与硫酸根离子生成硫酸钡沉淀:Ba2++SO42-=BaSO4↓,铁与氢离子反应生成氢气和亚铁离子:Fe+2H+=Fe2++H2↑,
故答案为:Ba2++SO42-=BaSO4↓、Fe+2H+=Fe2++H2↑;
(2)4.66g白色沉淀为硫酸钡,硫酸钡的物质的量与原溶液中硫酸的物质的量相等,则:n(H2SO4)=n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,所以原溶液中硫酸的物质的量浓度为:c(H2SO4)=$\frac{0.02mol}{0.02L}$=1mol/L;
加入足量铁粉后生成的气体为氢气,标况下896mL氢气的物质的量为:$\frac{0.896L}{22.4L/mol}$=0.04mol,生成0.04mol氢气需要消耗0.08mol氢离子,则氢离子浓度为:$\frac{0.08mol}{0.02L}$=4mol/L,其中1mol/L的硫酸中氢离子浓度为2mol/L,则c(HCl)=c(H+)盐酸电离的=4mol/L-1mol/L×2=2mol/L,
故答案为:1;2.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握质量守恒在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案| A. | CH4 | B. | CH3Cl | C. | C2H6 | D. | C2H4 |
| A. | 不锈钢是一种纯净物,它比纯铁的硬度大 | |
| B. | 铝合金是用量最大、用途最广的合金 | |
| C. | 青铜、硬铝和生铁都属于合金 | |
| D. | Na-K合金的熔点介于Na和K单质熔点之间 |
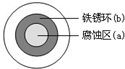
| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-→4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-→Cu2+ |
| A. | 陶瓷的主要成分是碳酸钙 | |
| B. | 用铁容器存放浓盐酸 | |
| C. | 硅是制造半导体的常用材料 | |
| D. | 工业上利用氨气制硝酸属于人工固氮 |
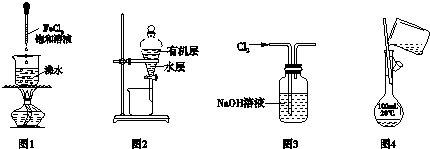
| A. | 用图1制备氢氧化铁胶体,当溶液至红褐色时继续煮沸 | |
| B. | 用图2所示装置分离CCl4萃取碘水后已分层的有机层和水层 | |
| C. | 用图3所示装置除去Cl2中含有的少量HCl气体 | |
| D. | 用图4所示装置配制实验所需100mL0.1mol/LNaCl溶液 |
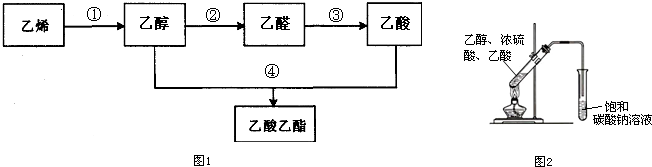
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.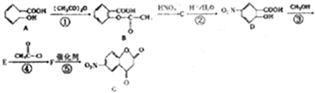
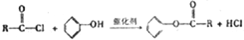
 .写出F与过量NaOH共热时反应的化学方程式
.写出F与过量NaOH共热时反应的化学方程式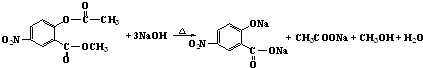 .
. 或
或 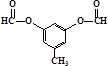 .
. 已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种已知轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种已知轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.