题目内容
9.氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高.(1)若电解质溶液为KOH,其正极反应为O2+4e-+2H2O=4OH-,负极反应为2H2-4e-+4OH-=4H2O.
(2)若电解质溶液为硫酸,其正极反应为O2+4e-+4H+=2H2O,负极反应为2H2-4e-=4H+.
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=0.3mol•L-1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体.计算:
①电解池阳极生成氯气的物质的量是0.015 mol.
②氢氧燃料电池中转移的电子数目是0.03NA个,消耗H2的质量是0.03 g.(写出计算过程)(保留2位小数)
分析 (1)氢氧燃料电池中,如果电解质溶液为碱,则正极上氧气得电子和水生成氢氧根离子,阴极上氢气失电子和氢氧根离子反应生成水;
(2)氢氧燃料电池中,如果电解质溶液为酸,则正极上氧气得电子和氢离子反应生成水,阴极上氢气失电子生成氢离子;
(3)用氢氧燃料电池电解NaCl和CuSO4组成的混合溶液时,阴极上先铜离子放电,后氢离子放电,根据转移电子数相等计算阳极生成氯气的物质的量和氢氧燃料电池外电路中转移电子数,根据氢气和转移电子之间的关系式计算氢气的质量.
解答 解:(1)氢氧燃料电池中,如果电解质溶液为碱,则正极上氧气得电子和水生成氢氧根离子,电极反应式为:O2+4e-+2H2O=4OH-,阴极上氢气失电子和氢氧根离子反应生成水,电极反应式为2H2-4e-+4OH-=4H2O,
故答案为:O2+4e-+2H2O=4OH-;2H2-4e-+4OH-=4H2O;
(2)氢氧燃料电池中,如果电解质溶液为酸,则正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4e-+4H+=2H2O,阴极上氢气失电子生成氢离子,电极反应式为:2H2-4e-=4H+,
故答案为:O2+4e-+4H+=2H2O;2H2-4e-=4H+;
(3)用氢氧燃料电池电解NaCl和CuSO4组成的混合溶液时,阴极上先铜离子放电,后氢离子放电,c(Na+)=3c(Cu2+)=0.3mol•L-1,即混合溶液中铜离子的浓度是0.1mol/L,100mL混合溶液中n(Cu2+)=0.1mol/L×0.1L=0.01mol,
析出0.01mol铜需要转移0.02mol电子,阴极上生成氢气需要转移电子的物质的量=$\frac{0.112}{22.4}$×2=0.01mol,串联电路中转移电子数相等,所以氢氧燃料电池外电路中转移电子数为0.03mol,
①电解池阳极生成氯气的物质的量是$\frac{0.03mol}{2}$=0.015mol,故答案为:0.015;
②串联电路中转移电子数相等,所以氢氧燃料电池外电路中转移电子数也为0.03NA,则消耗氢气的质量=$\frac{(0.02+0.01)mol}{2}$×2g/mol=0.03g,
故答案为:0.03NA;0.03.
点评 本题考查原电池原理及其相关计算,注意氢氧燃料电池中,电极反应式的书写要结合电解质溶液,电解质溶液不同则电极反应式不同.

| A. |  太阳能集热器 | B. |  锂离子电池 | C. |  电烤箱 | D. |  燃气灶 |
| A. | H2、CH4在负极失去电子,发生氧化反应 | |
| B. | 从产物推断,两种燃料电池的氧化剂均为O2 | |
| C. | 燃料电池将化学能直接转变为电能,能量转化率高 | |
| D. | 分别将1 mol H2与1 mol CH4做燃料电池的燃料,转移的电子一样多 |
| A. | N2和H2全部转化为NH3 | |
| B. | 正反应和逆反应的化学反应速率均为零 | |
| C. | N2、H2和NH3的物质的量浓度之比为1:3:2 | |
| D. | 若外界条件发生改变,化学反应的限度可能随之改变 |

| A. | 氯化钠是由钠离子和氯离子组成的化合物 | |
| B. | 氯化钠电离成钠离子和氯离子不需要通电 | |
| C. | 氯化钠的电离方程式为:NaCl═Na++Cl- | |
| D. | 水合钠离子和水合氯离子周围水分子数相同 |
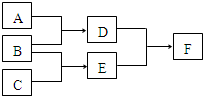 单质A、B、C和化合物D、E、F,在一定条件下有如图的转化关系(可能有部分生成物未标出),请回答下列问题:
单质A、B、C和化合物D、E、F,在一定条件下有如图的转化关系(可能有部分生成物未标出),请回答下列问题: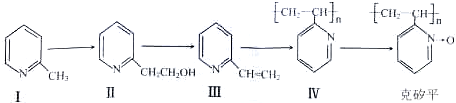
 ,其反应方程式为
,其反应方程式为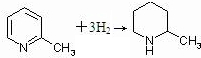 (不要求标出反应条件).
(不要求标出反应条件). (不要求标出反应条件).
(不要求标出反应条件).