20.下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
| A. | 合成氨工厂通常采用20 MPa~50 MPa压强,以提高原料的利用率 | |
| B. | 合成氨工业中使反应温度达到500℃有利于氨的合成 | |
| C. | 合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| D. | 阴暗处密封有利于氯水的储存 |
17.已知分解1molH2O2放出热量98kJ.在含有少量I-的溶液中,H2O2分解的机理为:
H2O2+I-→H2O+IO-
H2O2+IO-→H2O+O2+I-.
下列有关该反应的说法不正确的是( )
H2O2+I-→H2O+IO-
H2O2+IO-→H2O+O2+I-.
下列有关该反应的说法不正确的是( )
| A. | H2O2(l)═2H2O(g)+O2(g)△H=-196kJ•mol-1 | |
| B. | 在该反应中H2O2既做氧化剂.又做还原剂 | |
| C. | 反应速率与I-浓度有关 | |
| D. | v(H2O2)=v(H2O)=v(O2) |
16.用锌片与稀硫酸反应制取氢气时.下列措施使氢气生成速率变化最小的是( )
| A. | 加人少量硫酸铜晶体 | B. | 不用稀硫酸而用浓硫酸 | ||
| C. | 用锌粉代替锌片 | D. | 加少量BaCl2晶体 |
15.下列说法中正确的是( )
| A. | 化学反应速率通常只能用反应物浓度的减少量表示 | |
| B. | 加入反应物可使反应速率增大 | |
| C. | 在研究反应速率变化的实验中.同时改变两个变量一定能更快得出有关规律 | |
| D. | 对于反应2H2O2═2H2O+O2↑.加入MnO2或升高温度都能加快O2的生成速率 |
14.已知1mol燃料完全燃烧的数据分别为:
使用上述燃料.最能体现“低碳经济”理念的是( )
| 燃料 | 一氧化碳 | 甲烷 | 异辛烷(C8H18) | 乙醇 |
| △H | -283.0kJ•mol-1 | -891.0kJ•mol-1 | -5461.0kJ•mol-1 | -1366.8kJ•mol-1 |
| A. | 一氧化碳 | B. | 甲烷 | C. | 异辛烷 | D. | 乙醇 |
12.某同学在实验室中进行如下实验:
以下结论正确的是( )
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 |  |  |  |
| 现象 | 没有明显变化 | 有沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A. | Ⅰ中无明显变化,说明两溶液无离子反应 | |
| B. | Ⅱ中的白色沉淀为CuCl2 | |
| C. | Ⅱ中生成的BaSO4沉淀不是电解质 | |
| D. | Ⅲ中的离子方程式为2H++Zn═Zn2++H2↑ |
11.在无色透明的强酸性溶液中,能大量共存的离子组是( )
0 170121 170129 170135 170139 170145 170147 170151 170157 170159 170165 170171 170175 170177 170181 170187 170189 170195 170199 170201 170205 170207 170211 170213 170215 170216 170217 170219 170220 170221 170223 170225 170229 170231 170235 170237 170241 170247 170249 170255 170259 170261 170265 170271 170277 170279 170285 170289 170291 170297 170301 170307 170315 203614
| A. | K+、Ba2+、NO3-、SO42- | B. | K+、Na+、Cl-、ClO- | ||
| C. | Ca2+、NH4+、NO3-、Cl- | D. | K+、Na+、MnO4-、SO42- |
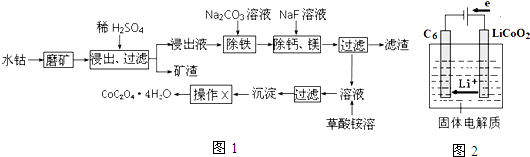
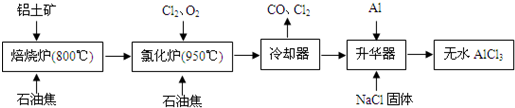
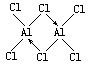 .
.