题目内容
19.水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084% CaO.从中提取钴的主要工艺流程如图1: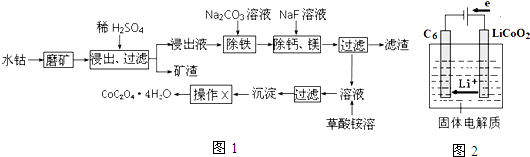
(1)请配平下列除铁的化学方程式:
□Fe2(SO4)3+□H2O+□Na2CO3=□Na2Fe6(SO4)4(OH)12↓+□Na2SO4+□CO2↑
(2)“除钙、镁”的原理反应为:MgSO4+2NaF═MgF2↓+Na2SO4,CaSO4+2NaF═CaF2↓+Na2SO4
已知KSP(CaF2)=1.11×10-10,KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$=1.5.
(3)“沉淀”中含杂质离子主要有SO42-、F-、NH4+和Na+;“操作X”包括洗涤和干燥.
(4)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分反应后,下列情况可能出现的是ab
a.溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu
b.溶液中有Fe2+、Al3+,不溶物为Cu、Fe
c.溶液中有Fe3+、Al3+,不溶物为Cu
d.溶液中有Fe2+,不溶物为Cu、Al
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图2所示).电池反应为LiCoO2+C6 $?_{放电}^{充电}$CoO2+LiC6,写出该电池放电时的正极反应式CoO2+Li++e-=LiCoO2.
分析 水钴矿磨矿将矿石粉碎,增大接触面积,加快反应速率,加入稀硫酸,矿渣为SiO2,滤液中含有:CoSO4、Fe2(SO4)3、MgSO4、CaSO4,加入碳酸钠,除去Fe2(SO4)3,加入氟化钠,除去钙镁,过滤得主要含CoSO4的溶液,加入草酸铵,通过沉淀、过滤、洗涤、干燥得到四水合草酸钴,
(1)根据原子守恒配平方程式;
(2)滤液中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$=$\frac{Ksp(Ca{F}_{2})}{Ksp(Mg{F}_{2})}$;
(3)根据流程图中加入的物质分析,该沉淀中吸附易溶于水的离子;得到的沉淀要进行洗涤和干燥,才能得到较纯净、干燥的物质;
(4)铝和铁都能把位于其后的金属从其盐溶液中置换出来,但铝的活泼性强于铁,铝先与盐溶液反应,然后铁与与盐溶液反应;
(5)放电时,该电池是原电池,正极上得电子发生还原反应.
解答 解:水钴矿磨矿将矿石粉碎,增大接触面积,加快反应速率,加入稀硫酸,矿渣为SiO2,滤液中含有:CoSO4、Fe2(SO4)3、MgSO4、CaSO4,加入碳酸钠,除去Fe2(SO4)3,加入氟化钠,除去钙镁,过滤得主要含CoSO4的溶液,加入草酸铵,通过沉淀、过滤、洗涤、干燥得到四水合草酸钴,
(1)根据原子守恒配平方程式,所以其方程式为3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6 (SO4)4(OH)12↓+5Na2SO4+6CO2↑,故答案为:3,6,6,1,5,6;
(2)滤液中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$=$\frac{Ksp(Ca{F}_{2})}{Ksp(Mg{F}_{2})}$=$\frac{1.1×1{0}^{-10}}{7.40×1{0}^{-11}}$=1.5,故答案为:1.5;
(3)该沉淀中吸附易溶于水的离子,根据流程图知,溶液中含有铵根离子和钠离子,所以沉淀上含有铵根离子和钠离子,得到的沉淀要进行洗涤和干燥才能得到较纯净、干燥的物质,故答案为:NH4+;Na+;洗涤;干燥;
(4)a.铝粉、铁粉都全部与溶液反应,且溶液过量,溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu,故a正确;
b.铝粉部分与溶液反应、铁粉与溶液未反应,溶液中有Fe2+、Al3+,不溶物为Cu、Fe,故b正确;
c.铝粉氯化铜溶液反应生成氯化亚铁和铜,不可能生成Fe3+,故c错误;
d.铝先与氯化铜溶液反应,然后铁与氯化铜溶液反应,只要铝剩余,铁与氯化铜溶液就不反应,溶液中就不可能含有Fe2+,故d错误;
故选:ab;
(5)放电时,该电池是原电池,正极上得电子发生还原反应,电极反应式为:CoO2+Li++e-=LiCoO2,故答案为:CoO2+Li++e-=LiCoO2.
点评 本题考查难溶电解质的溶解平衡、电极反应式的书写、物质的分离和提纯、物质性质的理解应用等知识点,难点是(2)题,明确溶度积常数的含义是解此题关键,电极反应式的书写是学习难点,要结合电解质溶液的酸碱性书写,难度中等.

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案| A. | 20℃0.1mol•L-1的盐酸溶液20 mL与0.5g块状碳酸钙反应 | |
| B. | 20℃0.2mol•L-1的盐酸溶液10mL与0.5g粉状碳酸钙反应 | |
| C. | 10℃0.2mol•L-1的盐酸溶液10mL与0.5g粉状碳酸钙反应 | |
| D. | 10℃0.1mol•L-1的盐酸溶液20 mL与1g块状碳酸钙反应 |
| A. | 1mol任何气体的体积都约是22.4L | |
| B. | 化学反应的本质就是原子之问的电子转移 | |
| C. | 在化学反应中,参加反应的各物质的质量比等于其物质的量之比 | |
| D. | 英国化学家波义尔提出元素的概念,标志着近代化学的诞生 |
| 燃料 | 一氧化碳 | 甲烷 | 异辛烷(C8H18) | 乙醇 |
| △H | -283.0kJ•mol-1 | -891.0kJ•mol-1 | -5461.0kJ•mol-1 | -1366.8kJ•mol-1 |
| A. | 一氧化碳 | B. | 甲烷 | C. | 异辛烷 | D. | 乙醇 |
| A. | 活化分子间所发生的碰撞为有效碰撞 | |
| B. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大的主要原因之一是增加了单位体积内活化分子的百分数 | |
| D. | 有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大 |
| A. | CuCl2 | B. | ZnCl2 | C. | FeCl3 | D. | AlCl3 |
| A. | HNO3→NO | B. | H2S→S | C. | FeCl2→FeCl3 | D. | SO32-→SO2 |