10.水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一.
检测水中的NO2-可用比色法,其步骤是:
a.配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液
b.配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对
苯磺酸粉末,实验结果如下表所示:
c.检测:取10mL水样倒入比色管中,加少许对氨基苯磺酸,显色后与标准色阶对比.
请填写以下空白:
①比色法的基本依据是溶液颜色的深浅与浓度的大小成正比;
②若水样显色后与色阶中的5号颜色相同,则表明水样中NO2-含量为1.00mg/L.
③用NaNO2直接配制溶液B的缺点是由②计算可知,1L溶液B中只含NO2-1mg,不易称量,直接配溶液B时误差大.
④如果水样显色后比6号还深,应采取的措施是将水样先稀释一定倍数后再重复实验.
检测水中的NO2-可用比色法,其步骤是:
a.配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液
b.配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对
苯磺酸粉末,实验结果如下表所示:
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
请填写以下空白:
①比色法的基本依据是溶液颜色的深浅与浓度的大小成正比;
②若水样显色后与色阶中的5号颜色相同,则表明水样中NO2-含量为1.00mg/L.
③用NaNO2直接配制溶液B的缺点是由②计算可知,1L溶液B中只含NO2-1mg,不易称量,直接配溶液B时误差大.
④如果水样显色后比6号还深,应采取的措施是将水样先稀释一定倍数后再重复实验.
9.氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
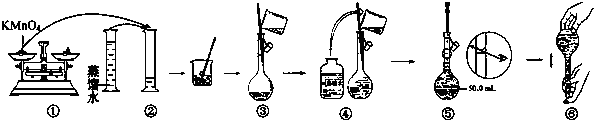
(1)如图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)已知:N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746kJ•mol-1
则反应CO(g)+$\frac{1}{2}$O2(g)═CO2(g)的△H=-283 kJ•mol-1
(3)在固定体积的密闭容器中,1.0×103kPa时,发生反应 N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
①K1>K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是bc(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2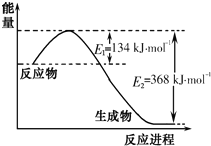
b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变.
(1)如图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)已知:N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746kJ•mol-1
则反应CO(g)+$\frac{1}{2}$O2(g)═CO2(g)的△H=-283 kJ•mol-1
(3)在固定体积的密闭容器中,1.0×103kPa时,发生反应 N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
②下列各项能说明上述合成氨反应一定达到平衡状态的是bc(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2

b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变.
7.资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理.
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红.
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为Mg(OH)2 .
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
(3)为进一步确定实验I的产物,设计定量实验方案,如图所示:
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验前后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 .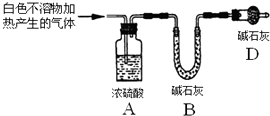
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红.
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为Mg(OH)2 .
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 氢气 |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤, 加入足量稀盐酸 | 产生气泡沉淀全部溶解 | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加 入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在④ CO32-离子 |
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验前后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 .

4.下列实验不能达到目的是( )
| A. |  如图证明酸性:盐酸>碳酸>苯酚 | |
| B. | 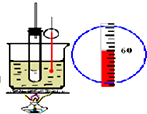 如图实验室制硝基苯 | |
| C. | 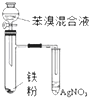 如图验证苯和液溴在催化剂作用下发生取代反应 | |
| D. | 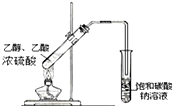 如图实验室制乙酸乙酯 |
2.工业生产苯乙烯是利用乙苯的脱氢反应: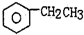 (g)$\stackrel{560℃}{?}$
(g)$\stackrel{560℃}{?}$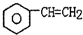 (g)+H2(g)△H<0
(g)+H2(g)△H<0
针对上述反应,在其它条件不变时,下列说法正确的是( )
0 170087 170095 170101 170105 170111 170113 170117 170123 170125 170131 170137 170141 170143 170147 170153 170155 170161 170165 170167 170171 170173 170177 170179 170181 170182 170183 170185 170186 170187 170189 170191 170195 170197 170201 170203 170207 170213 170215 170221 170225 170227 170231 170237 170243 170245 170251 170255 170257 170263 170267 170273 170281 203614
 (g)$\stackrel{560℃}{?}$
(g)$\stackrel{560℃}{?}$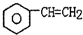 (g)+H2(g)△H<0
(g)+H2(g)△H<0针对上述反应,在其它条件不变时,下列说法正确的是( )
| A. | 加入适当催化剂,可以提高乙苯的转化率 | |
| B. | 在保持体积一定的条件下,充入较多的乙苯,可以提高乙本的转化率 | |
| C. | 在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量不变 | |
| D. | 仅从平衡移动的角度分析,工业生产苯乙稀选择恒压条件优于恒容条件 |
 .
.
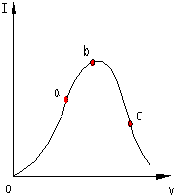 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
 通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ): $→_{△}^{浓H_{2}SO_{4}}$C3H4O2(Ⅲ)$\stackrel{C_{2}H_{5}OH/H+}{→}$C5H8O2$→_{一定条件}^{HBr}$(Ⅱ)
$→_{△}^{浓H_{2}SO_{4}}$C3H4O2(Ⅲ)$\stackrel{C_{2}H_{5}OH/H+}{→}$C5H8O2$→_{一定条件}^{HBr}$(Ⅱ) .
. ,反应类型是酯化反应(或取代反应).
,反应类型是酯化反应(或取代反应). .
.