题目内容
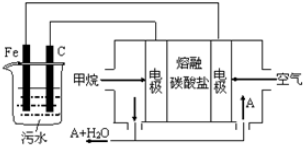
8.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣.此时,可向污水中加入适量的ae.
a.Na2SO4 b.H2SO4 c.NaOH d.CH3COOH e.NaCl
(2)除污过程中污水池中阳离子将移向阴极(填:“正”或“负”或“阴”或“阳”).
(3)电解池阳极发生了两个电极反应,电极反应式是Ⅰ.Fe-2e-═Fe2+Ⅱ.2H2O-4e-=4H++O2↑.
(4)以上电解过程是以上图右侧的燃料电池为电源,该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.
①负极的电极反应是CH4+4CO32--8e-=5CO2+2H2O;
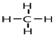
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的电子式为
 .
.(5)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)11.2L.
分析 (1)从所加入物质能增大溶液离子浓度,并能保持污水的pH在5.0~6.0之间考虑;
(2)除污过程为电解过程,所以污水池中阳离子将移向阴极;
(3)根据电极材料和离子的放电顺序考虑;
(4)①燃料电池中,正极发生的反应是氧气得电子被还原的过程,负极发生的反应是燃料失电子被氧化的过程;
②电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳;
(5)在燃料电池和电解池的串联电路中,转移的电子数目是相同的.
解答 解:(1)为了增强溶液的导电性,因此可选用易溶性强电解质溶液,排除d,考虑到题中要求电解时保持污水的pH在5.0~6.0之间,因此不能添加NaOH、H2SO4,故答案为:ae;
(2)除污过程为电解过程,所以污水池中阳离子将移向阴极,故答案为:阴;
(3)电解时铁作阳极,因此主要发生Fe-2e-=Fe2+,同时也发生副反应,即溶液中的OH-失电子被氧化生成O2,故答案为:2H2O-4e-=4H++O2↑;
(4)①燃料电池中,正极反应一定是氧气得电子,该电池的电解质环境是熔融碳酸盐,所以正极反应为:O2+2CO2+4e-=2CO32-;负极反应是CH4失电子,该电池的电解质环境是熔融碳酸盐,所以负极反应为:CH4+4CO32--8e-=5CO2+2H2O;故答案为:CH4+4CO32--8e-=5CO2+2H2O;
②电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳,电子式为 ;故答案为:
;故答案为: ;
;
(5)阴极的电极反应为:2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为4mol,根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,当转移0.1mol电子时,消耗CH4(标准状况)的体积V=nVm=0.5mol×22.4L/mol=11.2L,故答案为:11.2.
点评 本题考查原电池和电解池的知识,较为综合,做题时注意利用守恒的思考去解答,同时注意电极反应式的书写.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | 氯化镁 | B. | 碳酸氢铵 | C. | 硫酸钾 | D. | 亚硫酸 |
| NaCl | MgCl2 | CaCl2 | SiCl4 | |
| 熔点(℃) | 801 | 712 | 782 | -68 |
| 沸点(℃) | 1 465 | 1 412 | 1 600 | 57.6 |
①CaCl2属于离子晶体 ②SiCl4是分子晶体
③1500℃时,NaCl可气化 ④MgCl2水溶液不能导电.
| A. | 仅① | B. | 仅② | C. | ①②④ | D. | ①②③ |
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | NaOH+HCl═NaCl+H2O | ||
| C. | Fe+CuSO4═Cu+FeSO4 | D. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 |
| A. | Br2+2NaI═2NaBr+I2 | B. | Zn+H2SO4═ZnSO4+H2↑ | ||
| C. | 2C+SiO2$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑ | D. | 4Al+3MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$3Mn+2Al2O3 |
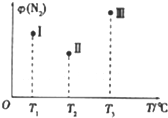 在容积均为500mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1molN2和2.5molH2,三个容器的反应温度分别为T1,T2,T3,且恒定不变.在其他条件相同的情况下发生反应:N2+3H2?2NH3△H<0.实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )
在容积均为500mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1molN2和2.5molH2,三个容器的反应温度分别为T1,T2,T3,且恒定不变.在其他条件相同的情况下发生反应:N2+3H2?2NH3△H<0.实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )| A. | 当v(H2)=3v(N2)时.可以说明三个容器中的反应达平衡状态 | |
| B. | 在t min时,一定达化学平衡状态的是III | |
| C. | 在t min时测得Ⅲ中c(N2)=1mol•L-1,若再向Ⅲ中充人1.5molN2和1molNH3,H2的转化率增大 | |
| D. | 三个容器中的反应均达到平衡后.氨气的质量分数Ⅰ>Ⅱ>Ⅲ |
 .
.