题目内容
6.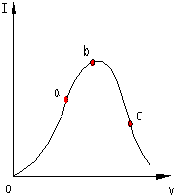 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:(1)“O”点导电能力为O的理由是在“O”点处醋酸未电离,无离子存在;
(2)a,b,c三点溶液中c(H+)由小到大的顺序为c<a<b;
(3)若使C点溶液的c(CH3COO-)提高,在如下措施中可采取(填标号)BCEF.
A.加盐酸 B.加浓醋酸 C.加入固体KOH
D.加水 E.加固体CH3COONa F.加Zn粒
分析 (1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强;
(2)导电能力越强,离子浓度越大,氢离子浓度越大;
(3)使c(CH3COO-)增大,则使醋酸的电离平衡正移,或增加醋酸根的量.
解答 解:(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸中没有自由移动的离子,所以冰醋酸不导电,
故答案为:在“O”点处醋酸未电离,无离子存在;
(2)由于导电能力越强,溶液中离子浓度越大,氢离子浓度越大,
故答案为:c<a<b;
(3)A.加盐酸,氢离子浓度增大,醋酸的电离平衡逆移,c(CH3COO-)减小,故A错误;
B.加浓醋酸溶液中离子浓度增大,醋酸根离子浓度相应增大,故B正确;
C.加入固体KOH,消耗氢离子,则醋酸的电离平衡正移,c(CH3COO-)增大,故C正确;
D.加水稀释,促进醋酸的电离,但是溶液体积增大程度大,c(CH3COO-)减小,故D错误;
E.加固体CH3COONa,c(CH3COO-)增大,故E正确;
F、加Zn粒,Zn与氢离子反应,氢离子浓度减小,则醋酸的电离平衡正移,c(CH3COO-)增大,故F正确;
故答案为:BCEF.
点评 本题考查了弱电解质的电离,题目难度不大,注意把握决定溶液导电性的因素、影响电离平衡的因素等知识点.

练习册系列答案
相关题目
12.下列说法错误的是( )
| A. | 1mol 氢 | B. | 1mol O | C. | 1mol 二氧化碳 | D. | 1mol 水 |
18. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
1.00.50t(s)123c(mol/L)abcd
(1)已知升高温度,NO2的浓度减小,则该反应是放热反应.
(2)图中表示NO2的变化的曲线是b
用O2表示从0~2s内该反应的平均速率v=0.15mol/(L•s)
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 2.0 | 1.0 | 0.8 | 0.7 | 0.7 | 0.7 |
(1)已知升高温度,NO2的浓度减小,则该反应是放热反应.
(2)图中表示NO2的变化的曲线是b
用O2表示从0~2s内该反应的平均速率v=0.15mol/(L•s)
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
15.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | 食盐水 | B. | CO2 | C. | NaHCO3 | D. | 氢氧化钠 |
16.用X、Y、Z、w四种金属进行如下实验:
根据以上事实.下列判断或推测错误的是( )
| 1 | 将X与Y用导线连接,浸入电解质溶液中,Y极上有气泡产生 |
| 2 | 将片状X、W分别投入等浓度的稀盐酸中都有气体产生,W比X反应剧烈 |
| 3 | 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出Z |
| A. | 上述四种金属中,Z的单质还原性最弱 | |
| B. | w的还原性强于Y的还原性 | |
| C. | Z放人CuSO4溶液中一定有Cu析出 | |
| D. | 用X、Z和稀硫酸可构成原电池,X作负极 |

 、
、 、
、 .
. .
.