20.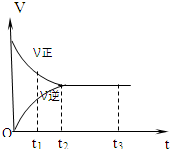 如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
 如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正方向反应没有逆方向反应 | |
| B. | t2时,反应已达到平衡状态 | |
| C. | t2-t3,各物质的浓度发生变化 | |
| D. | t2-t3,处于静止状态,反应不再发生 |
18.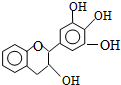 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 分子中所有的原子共面 | B. | 1molEGC与3molNaOH恰好完全反应 | ||
| C. | 它具有酯的性质 | D. | 遇FeCl3溶液发生显色反应 |
17.A、B、C、D、E是元素周期表前四周期中的五种常见元素,其相关信息如下表:
请回答下列问题
(1)C元素原子的价电子排布图是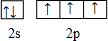
(2)E元素位于周期表ds区,E+离子的核外电子排布式是1s22s22p63s23p63d10
(3)CA3极易溶于水的主要原因是NH3与H2O分子间形成氢键C3-离子的中心原子采用sp杂化,C3-离子的空间构型是直线型
(4)A、C、E三种元素可形成〔E(CA3)4〕2+配离子,其中存在的化学键类型有①③(填序号,①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键)
(5)〔E(CA3)4〕2+可由E的硫酸盐溶液中通入过量CA3气体得到,写出该配离子的结构简式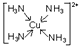 .
.
| 元素 | 相关信息 |
| A | A原子的1S轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2P轨道中有三个未成对电子 |
| D | D是主族元素且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
(1)C元素原子的价电子排布图是

(2)E元素位于周期表ds区,E+离子的核外电子排布式是1s22s22p63s23p63d10
(3)CA3极易溶于水的主要原因是NH3与H2O分子间形成氢键C3-离子的中心原子采用sp杂化,C3-离子的空间构型是直线型
(4)A、C、E三种元素可形成〔E(CA3)4〕2+配离子,其中存在的化学键类型有①③(填序号,①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键)
(5)〔E(CA3)4〕2+可由E的硫酸盐溶液中通入过量CA3气体得到,写出该配离子的结构简式
 .
.
16.氮元素的化合物种类繁多,性质也各不相同
(1)已知
①N2(g)+2O2(g)═N2O4(g)△H=+10.7KJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-624KJ/mol
写出气态肼和N2O4反应生成氮气和液态水的热化学方程式:2H2N4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1258.7kJ/mol
(2)一定温度下,在密闭容器中可逆反应:2NO2(g)?N2O4(g)△H<0,下列叙述正确的是AC
A.单位时间内生成1molN2O4的同时生成2molNO2,达到平衡状态
B.达到平衡后,其它条件不变,升高温度,容器内气体颜色变浅
C.置于绝热的恒容容器中,容器中气体颜色不变时,说明达到平衡状态
D.加入适当的催化剂,NO2的转化率可以增大
(3)在100℃时,将0.400mol的NO2气体充入2L的容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
①反应开始直至10min时,N2O4的平均反应速率为:0.0025mol/L•min
②升高温度后,平衡常数K将减低(填“增高”、“减低”或“不变”)
③若在相同情况下向该容器中只充入N2O4气体,要达到上述同样的平衡状态,N2O4的起始物质的量是0.200mol
(4)亚硝酸钠(NaNO2)是一种常见的食品添加剂,具有防腐和增色作用
①亚硝酸钠中氮元素的化合价为+3,由此推断其可能C.(填字母序号)
A.只有氧化性 B.只有还原性 C.既有氧化性,也有还原性
②已知亚硝酸属于弱酸,则NaNO2溶液显碱性;(填“酸性”、“中性”或“碱性”)原因是NO-+H2O?HNO2+OH-.(用离子方程式表示)
(5)肼-空气燃烧电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,放电时生成N2和水,则放电时负极电极反应式为N2H4-e-+4OH-=N2↑+4H2O.
(1)已知
①N2(g)+2O2(g)═N2O4(g)△H=+10.7KJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-624KJ/mol
写出气态肼和N2O4反应生成氮气和液态水的热化学方程式:2H2N4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1258.7kJ/mol
(2)一定温度下,在密闭容器中可逆反应:2NO2(g)?N2O4(g)△H<0,下列叙述正确的是AC
A.单位时间内生成1molN2O4的同时生成2molNO2,达到平衡状态
B.达到平衡后,其它条件不变,升高温度,容器内气体颜色变浅
C.置于绝热的恒容容器中,容器中气体颜色不变时,说明达到平衡状态
D.加入适当的催化剂,NO2的转化率可以增大
(3)在100℃时,将0.400mol的NO2气体充入2L的容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| n(NO2)/mol | 0.400 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②升高温度后,平衡常数K将减低(填“增高”、“减低”或“不变”)
③若在相同情况下向该容器中只充入N2O4气体,要达到上述同样的平衡状态,N2O4的起始物质的量是0.200mol
(4)亚硝酸钠(NaNO2)是一种常见的食品添加剂,具有防腐和增色作用
①亚硝酸钠中氮元素的化合价为+3,由此推断其可能C.(填字母序号)
A.只有氧化性 B.只有还原性 C.既有氧化性,也有还原性
②已知亚硝酸属于弱酸,则NaNO2溶液显碱性;(填“酸性”、“中性”或“碱性”)原因是NO-+H2O?HNO2+OH-.(用离子方程式表示)
(5)肼-空气燃烧电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,放电时生成N2和水,则放电时负极电极反应式为N2H4-e-+4OH-=N2↑+4H2O.
15.常温下0.1mol/LNH3•H2O的pH=a,下列能使溶液pH=a-1的措施是( )
| A. | 加水,使溶液体积变为原来的10倍 | B. | 升高温度(不考虑NH3的挥发) | ||
| C. | 加入适量的NH4Cl固体 | D. | 加入等体积0.2mol/L的氢氧化钠 |
14.某氢氧燃烧电池的电解质溶液为KOH溶液,下列有关该电池的叙述正确的是( )
| A. | 电池工作时,OH-向正极移动 | |
| B. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 工作一段时间后,电解质溶液的PH变大 | |
| D. | 用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mole-转移 |
13.已知符合分子式为C4H10O的饱和一元醇有4种,那么符合分子式为C5H10O2饱和一元羧酸有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
12.其它条件不变,升高温度下列数据不一定增大的是( )
| A. | 可逆反应的化学平衡常数K | B. | 0.1mol/LCH3COONa溶液的PH | ||
| C. | 水的离子积常数Kw | D. | 弱电解质的电离程度 |
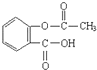
11.阿司匹林是常见的解热镇痛药,其结构简式如图所示,下列有关说法正确的是( )
0 170002 170010 170016 170020 170026 170028 170032 170038 170040 170046 170052 170056 170058 170062 170068 170070 170076 170080 170082 170086 170088 170092 170094 170096 170097 170098 170100 170101 170102 170104 170106 170110 170112 170116 170118 170122 170128 170130 170136 170140 170142 170146 170152 170158 170160 170166 170170 170172 170178 170182 170188 170196 203614

| A. | 阿司匹林的分子式为C9H10O4 | B. | 阿司匹林属于有机高分子化合物 | ||
| C. | 1mol阿司匹林最多能与5molH2加成 | D. | 阿司匹林具有酸性,能与NaOH反应 |
 ,在催化剂存在条件下1molD与2molH2反应可以生成乙;丙中含有两个-CH3
,在催化剂存在条件下1molD与2molH2反应可以生成乙;丙中含有两个-CH3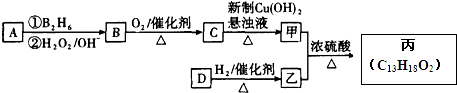
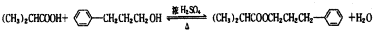 .
. .
.