题目内容
11.阿司匹林是常见的解热镇痛药,其结构简式如图所示,下列有关说法正确的是( )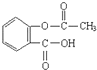
| A. | 阿司匹林的分子式为C9H10O4 | B. | 阿司匹林属于有机高分子化合物 | ||
| C. | 1mol阿司匹林最多能与5molH2加成 | D. | 阿司匹林具有酸性,能与NaOH反应 |
分析 该有机物中含有羧基、酯基和苯环,具有羧酸、酯和苯的性质,能发生酯化反应、取代反应、水解反应、加成反应,据此分析解答.
解答 解:A.根据结构简式知,阿司匹林的分子式为C9H8O4,故A错误;
B.高分子化合物相对分子质量在10000左右,该物质相对分子质量较小,所以不是高分子化合物,故B错误;
C.只有苯环能和氢气发生加成反应,1mol阿司匹林最多能与3molH2加成,故C错误;
D.含有羧基,所以具有酸性,含有酯基,能发生水解反应,所以能与氢氧化钠反应,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,注意酯基、羧基中碳氧双键不能发生加成反应、但酮基中碳氧双键能发生加成反应,为易错点.

练习册系列答案
相关题目
1.下列事实不能用勒夏特列原理解释的是( )
| A. | 增大压强能缩短碘化氢分解反应达到平衡的时间 | |
| B. | 配制硫酸铁溶液时,向溶液中加入少量硫酸 | |
| C. | 往醋酸溶液中加碱溶液,使c(CH3COO-) 增大 | |
| D. | 向水中加入酸可抑制水的电离 |
19.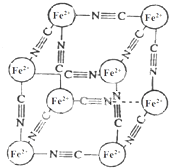 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )
 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )| A. | 该晶体中既有离子键又有极性共价键 | |
| B. | 晶体的化学式可表示为[M2Fe(CN)3] | |
| C. | M+离子位于晶胞体心 | |
| D. | 与每个Fe2+距离相等且最近的CN-有6个 |
6.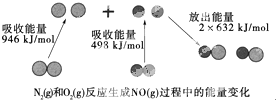 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
16.氮元素的化合物种类繁多,性质也各不相同
(1)已知
①N2(g)+2O2(g)═N2O4(g)△H=+10.7KJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-624KJ/mol
写出气态肼和N2O4反应生成氮气和液态水的热化学方程式:2H2N4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1258.7kJ/mol
(2)一定温度下,在密闭容器中可逆反应:2NO2(g)?N2O4(g)△H<0,下列叙述正确的是AC
A.单位时间内生成1molN2O4的同时生成2molNO2,达到平衡状态
B.达到平衡后,其它条件不变,升高温度,容器内气体颜色变浅
C.置于绝热的恒容容器中,容器中气体颜色不变时,说明达到平衡状态
D.加入适当的催化剂,NO2的转化率可以增大
(3)在100℃时,将0.400mol的NO2气体充入2L的容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
①反应开始直至10min时,N2O4的平均反应速率为:0.0025mol/L•min
②升高温度后,平衡常数K将减低(填“增高”、“减低”或“不变”)
③若在相同情况下向该容器中只充入N2O4气体,要达到上述同样的平衡状态,N2O4的起始物质的量是0.200mol
(4)亚硝酸钠(NaNO2)是一种常见的食品添加剂,具有防腐和增色作用
①亚硝酸钠中氮元素的化合价为+3,由此推断其可能C.(填字母序号)
A.只有氧化性 B.只有还原性 C.既有氧化性,也有还原性
②已知亚硝酸属于弱酸,则NaNO2溶液显碱性;(填“酸性”、“中性”或“碱性”)原因是NO-+H2O?HNO2+OH-.(用离子方程式表示)
(5)肼-空气燃烧电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,放电时生成N2和水,则放电时负极电极反应式为N2H4-e-+4OH-=N2↑+4H2O.
(1)已知
①N2(g)+2O2(g)═N2O4(g)△H=+10.7KJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-624KJ/mol
写出气态肼和N2O4反应生成氮气和液态水的热化学方程式:2H2N4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1258.7kJ/mol
(2)一定温度下,在密闭容器中可逆反应:2NO2(g)?N2O4(g)△H<0,下列叙述正确的是AC
A.单位时间内生成1molN2O4的同时生成2molNO2,达到平衡状态
B.达到平衡后,其它条件不变,升高温度,容器内气体颜色变浅
C.置于绝热的恒容容器中,容器中气体颜色不变时,说明达到平衡状态
D.加入适当的催化剂,NO2的转化率可以增大
(3)在100℃时,将0.400mol的NO2气体充入2L的容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| n(NO2)/mol | 0.400 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②升高温度后,平衡常数K将减低(填“增高”、“减低”或“不变”)
③若在相同情况下向该容器中只充入N2O4气体,要达到上述同样的平衡状态,N2O4的起始物质的量是0.200mol
(4)亚硝酸钠(NaNO2)是一种常见的食品添加剂,具有防腐和增色作用
①亚硝酸钠中氮元素的化合价为+3,由此推断其可能C.(填字母序号)
A.只有氧化性 B.只有还原性 C.既有氧化性,也有还原性
②已知亚硝酸属于弱酸,则NaNO2溶液显碱性;(填“酸性”、“中性”或“碱性”)原因是NO-+H2O?HNO2+OH-.(用离子方程式表示)
(5)肼-空气燃烧电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,放电时生成N2和水,则放电时负极电极反应式为N2H4-e-+4OH-=N2↑+4H2O.
3.下列排列顺序正确的是( )
①固体热稳定性:Na2CO3>CaCO3>NaHCO3
②微粒半径:F->Na+>Mg2+>S2-
③燃烧热:S(气体)>S(液体)>S(固体)
④物质的熔点:植物油>动物油.
①固体热稳定性:Na2CO3>CaCO3>NaHCO3
②微粒半径:F->Na+>Mg2+>S2-
③燃烧热:S(气体)>S(液体)>S(固体)
④物质的熔点:植物油>动物油.
| A. | ①③④ | B. | ①③ | C. | ①②③④ | D. | ②③④ |
1.已知某原子${\;}_{Z}^{A}$X的某能层电子排布为ns2np6nd5,下列说法中正确的是( )
| A. | 若n=4,则X是第四周期元素 | |
| B. | 若n=3,则Z可能等于25 | |
| C. | 若X是第四周期元素,则具有“ns2np6nd5”排布的原子一定只有2种 | |
| D. | 若n=4,则X的基态原子一定有10个s电子 |
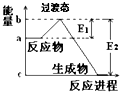 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.