题目内容
15.常温下0.1mol/LNH3•H2O的pH=a,下列能使溶液pH=a-1的措施是( )| A. | 加水,使溶液体积变为原来的10倍 | B. | 升高温度(不考虑NH3的挥发) | ||
| C. | 加入适量的NH4Cl固体 | D. | 加入等体积0.2mol/L的氢氧化钠 |
分析 A、因为氨水是弱碱,稀释过程中不断电离;
B、升温促进电离,氢氧根离子浓度增大;
C、NH3.H2O?NH4++OH-,当加入氯化铵时NH4+浓度增大,平衡左移,OH-浓度减少,PH减少;
D、若加入烧碱则OH-增大PH增大;
解答 解:A、因为氨水是弱碱,稀释过程中不断电离,所以稀释10倍时其PH应大于a-1小于a,故A错误;
B、升温促进电离,氢氧根离子浓度增大,不能保证PH=(a-1),故B错误;
C、NH3.H2O?NH4++OH-,当加入氯化铵时NH4+浓度增大,平衡左移,OH-浓度减少,PH减少,可以达到pH=a-1,故C正确;
D、若加入烧碱则OH-增大PH增大,不能保证PH=(a-1),故D错误;
故选C.
点评 本题考查了弱电解质电离平衡的分析应用主要是影响因素的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列有机化合物中沸点最高的是( )
| A. | 乙烷 | B. | 乙烯 | C. | 乙酸 | D. | 乙醇 |
6.下列叙述肯定正确的是( )
| A. | 在离子晶体中不可能存在非极性键 | |
| B. | 在共价化合物的分子晶体中不可能存在离子键 | |
| C. | 在极性分子中不可能存在非极性键 | |
| D. | 在原子晶体中不可能存在极性共价键 |
3.某种药物主要成分X的分子结构如图,关于有机物X的说法中,错误的是( )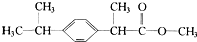

| A. | X难溶于水,易溶于有机溶剂 | B. | X能与液溴在一定条件下发生反应 | ||
| C. | X与酸、碱溶液均可以反应 | D. | X的水解产物能发生消去反应 |
10.在强酸性溶液中一定能大量共存的离子组是( )
| A. | OH-、Na+、K+、HCO3- | B. | Na+、K+、Cl-、Ag+ | ||
| C. | Mg+、SO42-、Na+、NO3- | D. | MnO4-、Fe2+、CO32-、Ba2+ |
20. 如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
 如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正方向反应没有逆方向反应 | |
| B. | t2时,反应已达到平衡状态 | |
| C. | t2-t3,各物质的浓度发生变化 | |
| D. | t2-t3,处于静止状态,反应不再发生 |
4.下列溶液中,物质的量浓度最大的是( )
| A. | 1L浓H2SO4中含有0.5gH2SO4 | B. | 0.5L含有49gH2SO4的溶液 | ||
| C. | 0.5gH2SO4溶于水配成2L溶液 | D. | 0.1L含24.5gH2SO4的溶液 |
5.外围电子构型为3d104s1的元素R( )
| A. | 位于第四周期第IA族 | |
| B. | 能形成稳定的R2+离子 | |
| C. | 在化学反应中,首先失去3d上的电子 | |
| D. | 原子序数为28 |
 铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题: