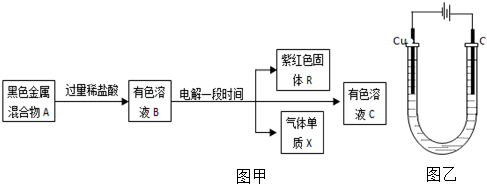
题目内容
14.某氢氧燃烧电池的电解质溶液为KOH溶液,下列有关该电池的叙述正确的是( )| A. | 电池工作时,OH-向正极移动 | |
| B. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 工作一段时间后,电解质溶液的PH变大 | |
| D. | 用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mole-转移 |
分析 KOH溶液为电解液的氢氧燃料电池中,通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,据此分析解答.
解答 解:A.放电时,电解质溶液中阴离子向负极移动,所以OH-向负极移动,故A错误;
B.通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故B正确;
C.根据电池反应式知,反应过程中KOH的物质的量不变,但有水生成,导致KOH的物质的量浓度降低,则溶液的pH减小,故C错误;
D.n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据化合价可知转移电子0.2mol,故D错误;
故选B.
点评 本题考查化学电源新型电池,为高频考点,明确离子移动方向、各个电极上发生的反应即可解答,难点是电极反应式的书写.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
5.下列过程中化学反应速率的加快对人类有益的是( )
| A. | 金属的腐蚀 | B. | 食物的腐败 | C. | 塑料的老化 | D. | 氨的合成 |
2.下列混合物,不论它们以何种比例混合,只要总质量一定,经完全燃烧后产生二氧化碳和水的量也一定的是( )
| A. | 乙炔和乙苯 | B. | 甲烷和乙烷 | ||
| C. | 乙醛和丙酮 | D. | 乙酸和乳酸[CH3CH(OH)COOH] |
9.下列反应必须加入氧化剂且一步反应就能完成的是( )
| A. | N2→NH3 | B. | N2→NO | C. | N2→NO2 | D. | NO2→NO |
3.下列化合物中阴阳离子半径之和最大的离子化合物是( )
| A. | NaF | B. | NaCl | C. | SO2 | D. | CaCl2 |
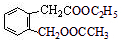 ,D的名称是乙醇.
,D的名称是乙醇.
 .
. ,在催化剂存在条件下1molD与2molH2反应可以生成乙;丙中含有两个-CH3
,在催化剂存在条件下1molD与2molH2反应可以生成乙;丙中含有两个-CH3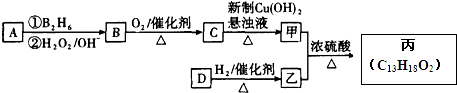
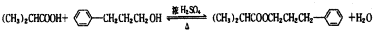 .
. .
.
 、
、 结构非常不稳定,会迅速转变为
结构非常不稳定,会迅速转变为

 .
.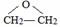 .
. .
.