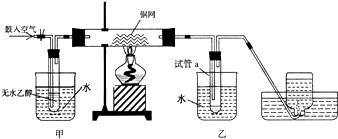
11.实验室中用二氧化锰和浓盐酸制氯气,主要操作有:①用药匙向烧瓶中加二氧化锰,再向分液漏斗中加入浓盐酸,并将导气管放入集气瓶中;②放置酒精灯,根据酒精灯确定铁圈高度,固定铁圈放置石棉网;③将烧瓶固定在铁架台上;④检查装置气密性;⑤装好分液漏斗,连接好导气管.则比较合理的实验操作顺序是( )
| A. | ②①④③⑤ | B. | ②③④①⑤ | C. | ②③⑤④① | D. | ①②③④⑤ |
10.下列说法不正确的是( )
| A. | 同种元素的质子数必定相同 | |
| B. | 元素的化学性质主要决定于原子的最外层电子数 | |
| C. | 原子核都是由质子和中子构成的 | |
| D. | 元素性质呈现周期性变化的根本原因是核外电子排布呈周期性变化 |
8.下表是不同温度下水的离子积数据:
试回答下列问题:
(1)若25<t1<t2,则α>1×10-14(填“>”“<”或“=”),作出此判断的理由是
升高温度,水的电离程度增大,离子积增大.
(2)已知25℃时饱和NaHCO3溶液的PH>7,则此温度下饱和NaHCO3溶液中各离子浓度关系正确的是AC
A.c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
B.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
(1)若25<t1<t2,则α>1×10-14(填“>”“<”或“=”),作出此判断的理由是
升高温度,水的电离程度增大,离子积增大.
(2)已知25℃时饱和NaHCO3溶液的PH>7,则此温度下饱和NaHCO3溶液中各离子浓度关系正确的是AC
A.c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
B.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
7.已知一定温度下合成氨反应:N2+3H2?2NH3,每生成2mol NH3放出92.4kJ的热量,在恒温、恒压的密闭容器中进行如下实验:①通入1mol N2和3mol H2,达平衡时放出热量为Q1,②通入2mol N2和6mol H2,达平衡时放出热量为Q2,则下列关系正确的是( )
| A. | Q2=2Q1 | B. | Q1<0.5 Q2 | C. | Q1<Q2<184.8 kJ | D. | Q1=Q2<92.4 kJ |
2.在密闭容器中发生反应aA(g)?cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
0 169958 169966 169972 169976 169982 169984 169988 169994 169996 170002 170008 170012 170014 170018 170024 170026 170032 170036 170038 170042 170044 170048 170050 170052 170053 170054 170056 170057 170058 170060 170062 170066 170068 170072 170074 170078 170084 170086 170092 170096 170098 170102 170108 170114 170116 170122 170126 170128 170134 170138 170144 170152 203614
| A. | A的转化率变大 | B. | 平衡向逆反应方向移动 | ||
| C. | C的体积分数变大 | D. | a>c+d |
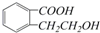 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: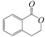 C.
C.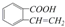 D.
D.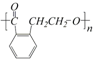 E.
E.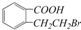
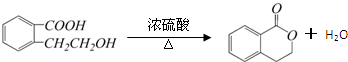 .
.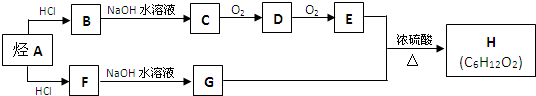

 CH3CH2COOCH(CH3)2+H2O.
CH3CH2COOCH(CH3)2+H2O.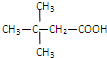 .(用结构简式表示)
.(用结构简式表示)