题目内容
7.已知一定温度下合成氨反应:N2+3H2?2NH3,每生成2mol NH3放出92.4kJ的热量,在恒温、恒压的密闭容器中进行如下实验:①通入1mol N2和3mol H2,达平衡时放出热量为Q1,②通入2mol N2和6mol H2,达平衡时放出热量为Q2,则下列关系正确的是( )| A. | Q2=2Q1 | B. | Q1<0.5 Q2 | C. | Q1<Q2<184.8 kJ | D. | Q1=Q2<92.4 kJ |
分析 1molN2(g)与3molH2(g)反应生成2molNH3(g)放出的热量是92.4kJ.恒温恒压下,反应前后气体的物质的量发生变化,①与②中n(N2):n(H2)=1:3,二者为等效平衡,反应物的转化率相同,②中参加反应的n(N2)是①中的2倍,据此判断.
解答 解:1molN2(g)与3molH2(g)反应生成2molNH3(g)放出的热量是92.4kJ,反应为可逆反应,物质不能完全反应,恒温恒压下,反应前后气体的物质的量发生变化,①与②中n(N2):n(H2)=1:3,二者为等效平衡,反应物的转化率相同,②中参加反应的n(N2)是①中的2倍,所以Q2=2 Q1<184.8 kJ.
故选A.
点评 考查热化学方程式的意义、反应热的计算、可逆反应特征、等效平衡等,难度中等,注意掌握等效平衡规律、理解热化学方程式意义.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
18.现有三种常见的治疗胃病的药品标签:
INDICALM消化药片每片含250mg碳酸钙
Stomachease减缓胃痛每片含250mg氢氧化镁
Fast digestion帮助消化每片含250mg氧化镁
药品中所含的物质均能与胃里过量的盐酸反应,则相同粒数的三种药片消耗HCl的物质的量比较,正确的是( )
INDICALM消化药片每片含250mg碳酸钙
Stomachease减缓胃痛每片含250mg氢氧化镁
Fast digestion帮助消化每片含250mg氧化镁
药品中所含的物质均能与胃里过量的盐酸反应,则相同粒数的三种药片消耗HCl的物质的量比较,正确的是( )
| A. | ①=②=③ | B. | ①>②>③ | C. | ③>②>① | D. | ②>③>① |
2.在密闭容器中发生反应aA(g)?cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
| A. | A的转化率变大 | B. | 平衡向逆反应方向移动 | ||
| C. | C的体积分数变大 | D. | a>c+d |
19.以下有关原子结构、元素周期律及元素周期表的叙述正确的是( )
| A. | 所有主族元素原子的最外层电子数都等于元素的最高正化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| C. | 第IA族元素从上到下,单质的熔点逐渐降低 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
16.下列装置或操作不能达到实验目的是( )
| A. | 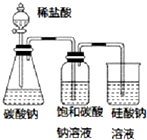 图中的实验现象能证明非金属性:Cl>C>Si | |
| B. | 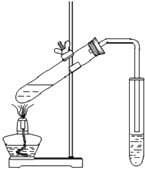 图可用于实验室制备并收集乙酸乙酯 | |
| C. |  图中,气体从a口进入时,可用于收集H2、CH4、NH3等气体 | |
| D. | 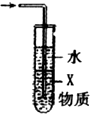 图中X若为CCl4,可用于吸收NH3或HCl |
